Медиатека
Свет в пробирке – о биолюминесценции в природе и науке
Оглавление:
•
Биолюминесценция в природе
•
Реакция биолюминесценции и разнообразие биолюминесцентных систем
•
Популярные люциферазы и субстраты
•
Области применения биолюминесцентных систем
Одной из самых ярких составляющих культового фильма «Аватар» была живописная планета Пандора, населенная удивительной флорой и фауной. Ночью растения и животные светились огнями невероятных цветов, заполняя сказочным светом всё вокруг. Нам остается лишь догадываться, как все это устроено на Пандоре, но на Земле мы точно знаем о биолюминесценции – способности живых организмов светиться в видимом диапазоне. И ученые уже довольно хорошо изучили это явление. В нашем обзоре мы расскажем о биолюминесценции, участниках и механизмах этого процесса, а также о том, как ученые придумали использовать его на практике.
Биолюминесценция в природе
Биолюминесценция – явление нечастое, но всегда очень эффектное и запоминающееся. Рой светлячков в ночном лесу, светящийся планктон на морском побережье, грибы, излучающие таинственный зеленый свет, черви, освещающие пещерные своды – зрелище очень завораживающее.
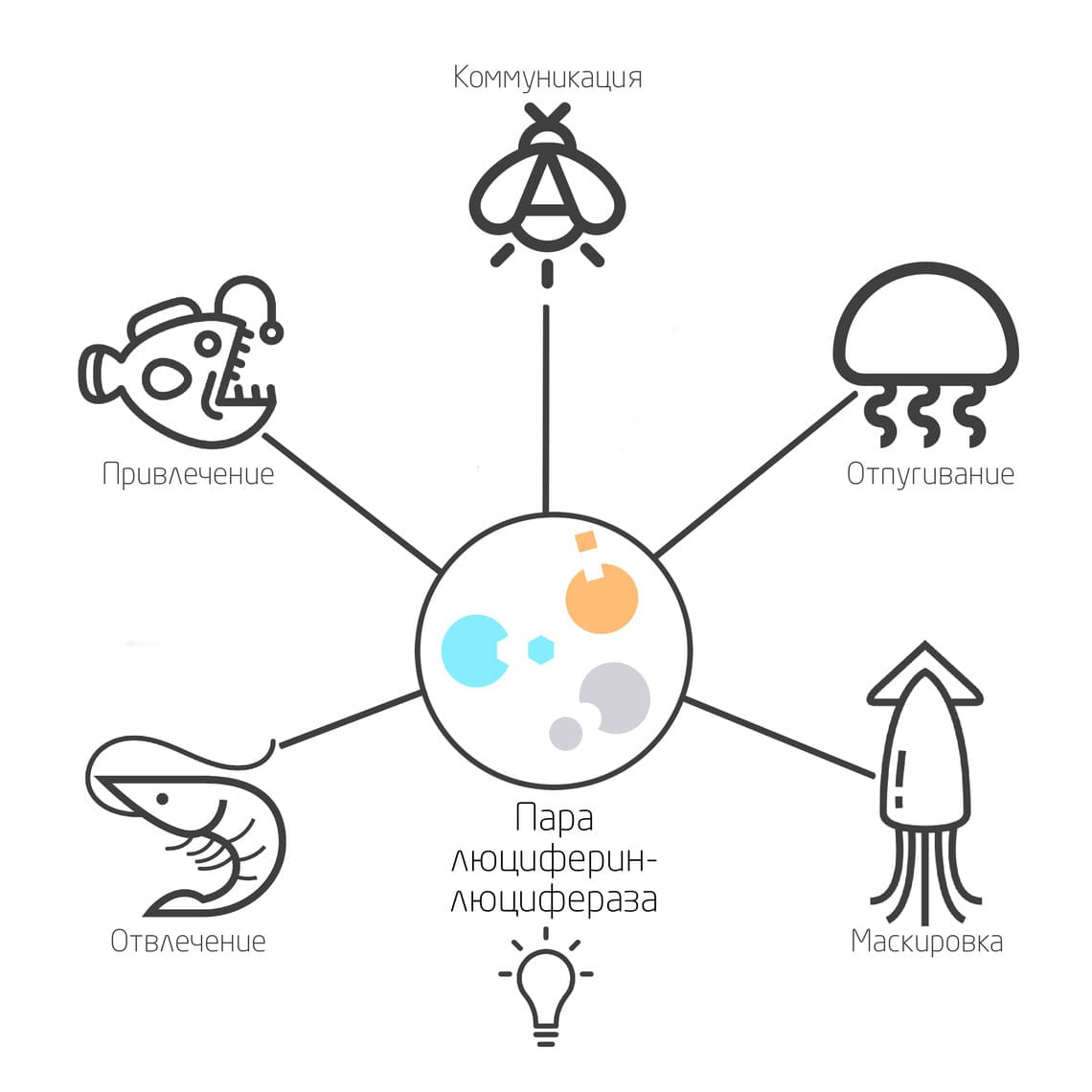
Светоизлучающие организмы встречаются в разных таксономических группах, даже эволюционно очень далеких. Описаны разные виды светящихся бактерий, простейших, грибов, моллюсков, червей, ракообразных, насекомых, некоторых рыб и т.д. Биологические функции люминесценции могут носить разный характер: отпугивание хищников, привлечение партнеров, маскировка, сигналинг, коммуникация и многое другое. К текущему моменту открыто около 40 механизмов биолюминесценции, но изучены только 11 из них. Интересно, что механизмы люминесценции в разных таксонах возникали и развивались эволюционно независимо друг от друга. 1
В основе природных биолюминесцентных систем лежит два принципа – ферменты люциферазы и фотобелки. Особенностью фотобелков является то, что светоизлучающий хромофор входит в состав самого белка, а излучение света вызывается внешним стимулом (например, ионами Ca2+). Люциферазы – это ферменты, которые катализируют реакцию с участием особых субстратов.
Реакция биолюминесценции и разнообразие биолюминесцентных систем
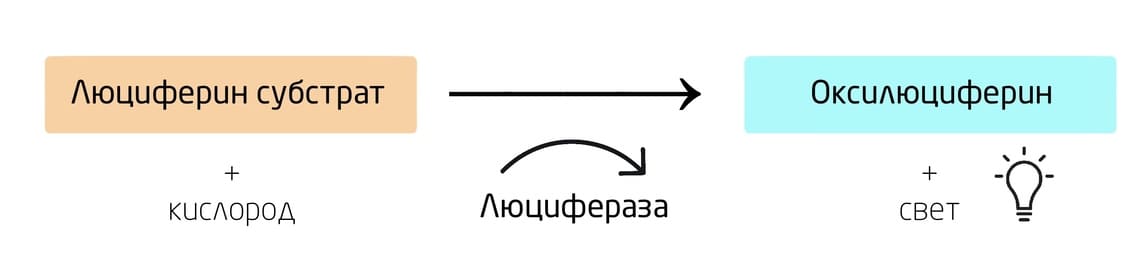
Биолюминесценция основана на химической реакции окисления низкомолекулярного субстрата люциферина кислородом воздуха, который катализируется ферментом люциферазой (Рис. 1). Релаксация продукта окисления люциферина из возбужденного состояния сопровождается испусканием кванта света, который может быть обнаружен как аналитический сигнал.
Рис. 1. Общая схема реакции биолюминесценции.
Возможность экспрессировать гены люцифераз в различных гетерологичных системах и высокие квантовые выходы люминесцентных реакций сделали их достаточно популярными в биологии. Несколько наиболее хорошо изученных люцифераз нашли применение в многочисленных аналитических методах и медицине. 2, 3, 4
Такие параметры, как размер, длина волны максимума люминесценции, термостабильность, оптимальный pH реакции и потребность в кофакторах могут различаться для люцифераз из разных групп организмов. Это влияет на выбор области применения каждого фермента. В таблице 1 представлены известные люминесцентные организмы и характеристики соответствующих природных люцифераз.
| Люцифераза (организм) / субстрат | Преимущества | Недостатки |
| Fluc (светлячок) / D-люциферин |
• Цветовая вариабельность • Яркость свечения • Доступны улучшенные версии люцифераз и модифицированные аналоги субстратов |
• Чувствительность к pH, температуре, бивалетным ионам металлов • Требование ко-факторов (ATP, Mg+) |
| CBluc (жук-щелкун) / D-люциферин |
• Цветовая вариабельность • Доступен в красном спектре • Нечувствительность к pH |
• Склонность к агрегации • Требование ко-факторов (ATP, Mg+) |
| Фриксотрикс («железнодорожный» червь) / D-люциферин |
• Доступен в красном спектре • Нечувствительность к pH |
Свойства плохо изучены |
| Rluc (коралл Renilla) / целентеразин | • Температруный оптимум 18-37°С |
• Низкий квантовый выход • Синий спектр излучения |
| Gluc, MLuc (копеподы Gaussia, Metridia longa) / целентеразин |
• Маленький размер • Высокая интенсивность свечения • Оптимальная стабильность белка • Секретируемый белок • Термостабильность |
• До 5 дисульфидных мостиков (S-S) в белке • Быстрое угасание светового сигнала • Синий спектр излучения |
| NanoLuc (креветка) / аналог целентеразина |
• Маленький размер • Высокая интенсивность свечения • Секретируемый белок |
• Синий спектр излучения • Высокая стоимость реагентов |
| CLuc (остракоды) / варгулин |
• Оптимальная стабильность белка • Секретируемый белок • Высокий квантовый выход реакции |
• Нестабильный белок • Модификации белка (гликозилирование) • 16 дисульфидных мостиков в белке • Высокая стоимость субстрата • Синий спектр излучения |
| nnLuz (грибы) |
• Автономная система биолюминесценции • Простой и дешевый субстрат |
• Мембранный белок • Низкий квантовый выход |
| Бактерии | Автономная система биолюминесценции |
• Гетеродимерные белки • Токсичность бактериальных люциферинов для эукариотических клеток |
Таблица 1. Практически значимые преимущества и недостатки природных люцифераз. 5
Популярные люциферазы и субстраты
Наиболее хорошо исследованными на данный момент и чаще всего используемыми парами являются D-люциферин и целентаразин и соответствующие им люциферазы.
1. D-люциферин и люцифераза светлячка
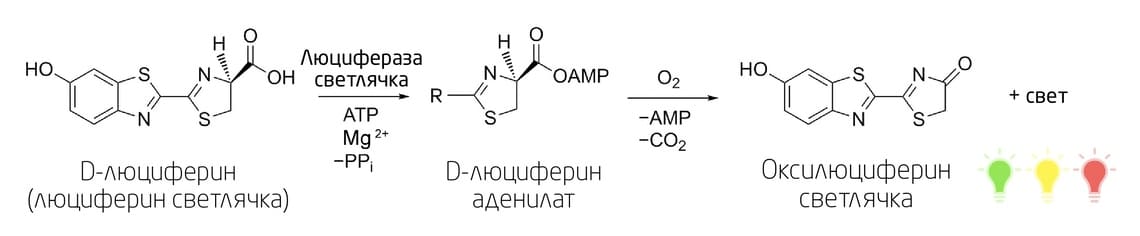
D-люциферин был впервые открыт у светлячков, а затем и у других видов насекомых (жуков, полужесткокрылых, двукрылых и ногохвосток). Реакция биолюминесценции, катализируемая люциферазой светлячка, протекает в две стадии (Рис. 2): аденилирование D-люциферина и окисление аденил-люциферина до оксилюциферина. Для протекания реакции необходимо присутствие кофакторов – молекул АТФ и ионов Mg2+. Для разных видов светлячков и других организмов, использующих D-люциферин, диапазон максимумов эмиссии света варьируется от зеленого (534 нм) до красного (638 нм). Однако при снижении рН, повышении температуры или при наличии ионов двухвалентных металлов происходит сдвиг эмиссионного спектра в длинноволновую область. В ряде случаев это может негативно сказаться на результатах исследования. Кроме того, природная люцифераза светлячка термически нестабильна и может инактивироваться при температуре выше 30°С. 5
Рис. 2. Реакция биолюминесценции на основе окисления D-люциферина.
Люцифераза светлячка, часто обозначаемая как Fluc (от англ. firefly luciferase), уже довольно хорошо изучена, исследованы её ферментативная активность, аминокислотная последовательность и доменная архитектура, разрешены трехмерные структуры. 6 Полученная информация способствовала разработке и успешному использованию генетически модифицированных люцифераз с улучшенными свойствами на основе люциферазы светлячка – pH- и термостабильных, химиорезистентных, с укороченным временем полураспада и измененными спектрами эмиссии и других. Искусственно синтезированные аналоги D-люциферина также позволили изменять длину волны максимума люминесценции.
Люцифераза светлячка – мономерный глобулярный белок, не требующий никаких пост-трансляционных модификаций для активности, а его экспрессия даже в больших количествах не является токсичной для клеток. Субстрат D-люциферин хорошо растворим в воде, нетоксичен для клеток, проникает через клеточную мембрану. Благодаря этим свойствам данная пара – очень эффективный инструмент в разных отраслях науки.
2. Люцифераза коралла Renilla и другие люциферазы
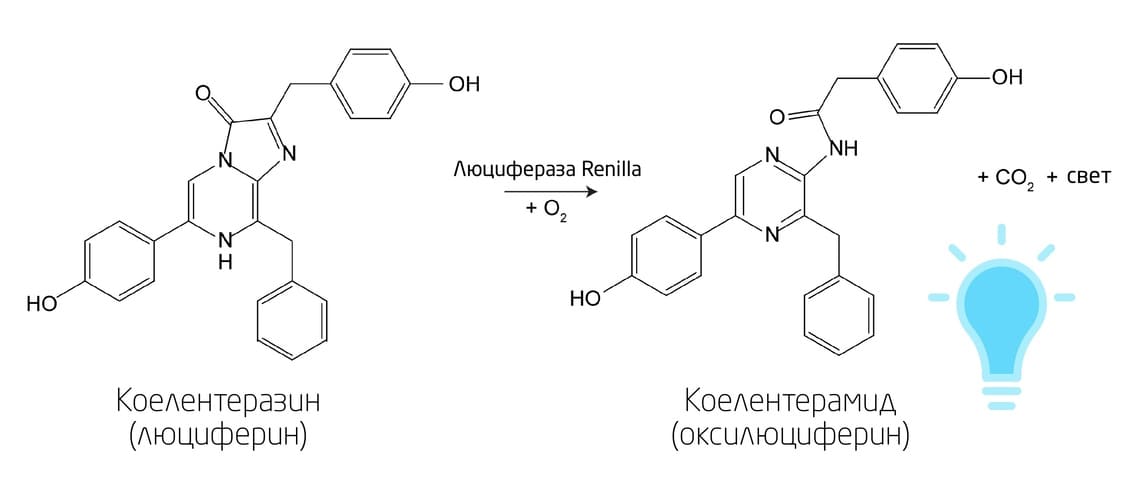
Морские организмы, в числе которых мягкие кораллы, копеподы и остракоды (морские ракообразные), головоногие моллюски (кальмары), сцифоидные медузы и десятиногие (креветки), составляют значительную долю всех известных биолюминесцентных видов. Для большинства из них биолюминесцентным субстратом является целентеразин, или коэлентеразин (оба перевода встречаются в литературе) (Рис. 3). Все целентеразин-зависимые природные системы излучают синий свет с максимумом излучения в диапазоне 450–500 нм и обычно не требуют каких-либо кофакторов, кроме кислорода. 7
Рис. 3. Реакция биолюминесценции на основе окисления D-люциферина.
Люцифераза из коралла морские анютины глазки (Renilla reniformis), обозначаемая аббревиатурой Rluc (Renilla luciferase), благодаря ряду свойств стала второй по популярности люциферазой, используемой в исследовательских целях. Это небольшой мономерный белок (36 кДа) с оптимальными значениями температуры (18-37°C) и pH (6.0-7.0) для активности. Синий спектр эмиссии и низкий квантовый выход делают Rluc более предпочтительной в in vitro исследованиях, чем in vivo, поскольку гемоглобин поглощает синий свет. Кроме того, необходимый для люминесценции целентеразин хуже растворим и более токсичен для клеток, чем D-люциферин. Однако, как и в случае с Fluc, методами случайного и сайт-направленного мутагенеза удалось получить усовершенствованные версии Rluc и синтезировать более физиологичные аналоги целентеразина. 5
В то время как Fluc и Rluc исторически были лучше исследованы и первыми применены на практике, набирают популярность и другие люциферазы, имеющие свои преимущества и недостатки (Таблица 1): GLuc и Mluc из веслоногих рачков (копепод) Gaussia princeps и Metridia longa, соответсвенно, CLuc из ракушкового рачка (остракоды) Cypridina, NanoLuc – модифицированный вариант люциферазы OLuc из креветки Oplophorus gracilirostris и другие. 2, 3
У светящихся бактерий вся система биолюминесценции закодирована в едином опероне. Экспрессия генов этого оперона в эукариотических клетках позволяет получить автономную биолюминесцентную систему, не требующую поступления субстрата извне. 8 Относительно недавно российские ученые полностью расшифровали биохимический путь, генерирующий биолюминесценцию у эукариотических организмов – грибов – и создали на ее основе более оптимизированную автономную светоизлучающую систему. 9
Области применения биолюминесцентных систем
Свет, испускаемый в ходе реакции биолюминесценции, может быть детектирован с помощью специального прибора – люминометра. При этом световой сигнал может служить не только качественным, но и количественным показателем, так как интенсивность излучения пропорциональна активности реакции. Эти свойства легли в основу многочисленных аналитических методов, основанных на компонентах биолюминесцентных систем. 2, 3, 4
Одним из самых распространенных применений Fluc и Rluc является их использование в качестве репортерных генов для количественного анализа экспрессии генов, изучения активности промоторов и разных регуляторных элементов на уровне ДНК и РНК. 10 Эти люциферазы можно использовать как независимо, так и в составе двойной репортерной системы (Рис. 4), где одна из люцифераз выступает в качестве внутреннего контроля. Двойной биолюминесцентный анализ с использованием одновременно двух люцифераз Fluc и Rluc возможен из-за различий в ферментах, субстратах и эмиссии для каждой реакции.
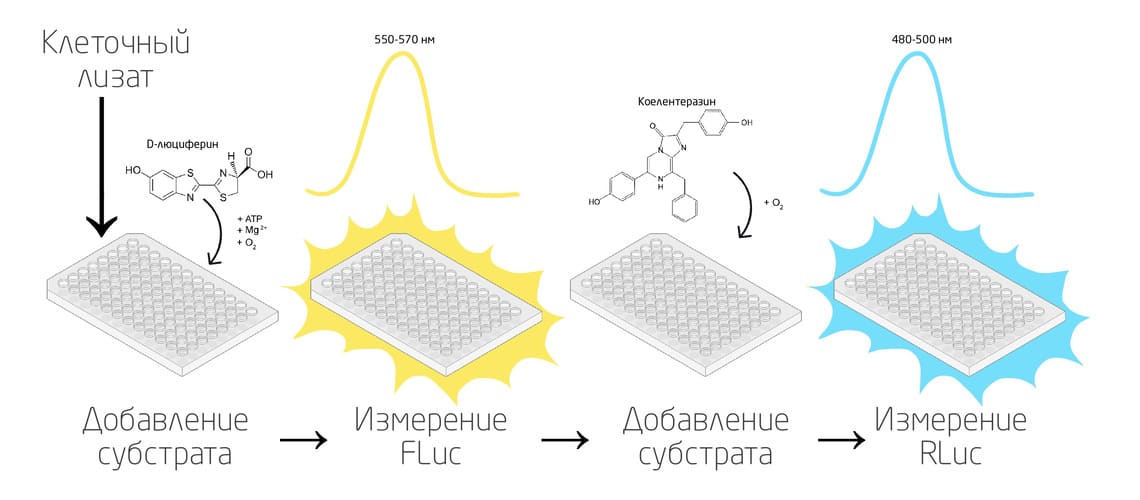
Рис. 4. Схема двойной репортерной системы с использованием люцифераз Fluc и Rluc.
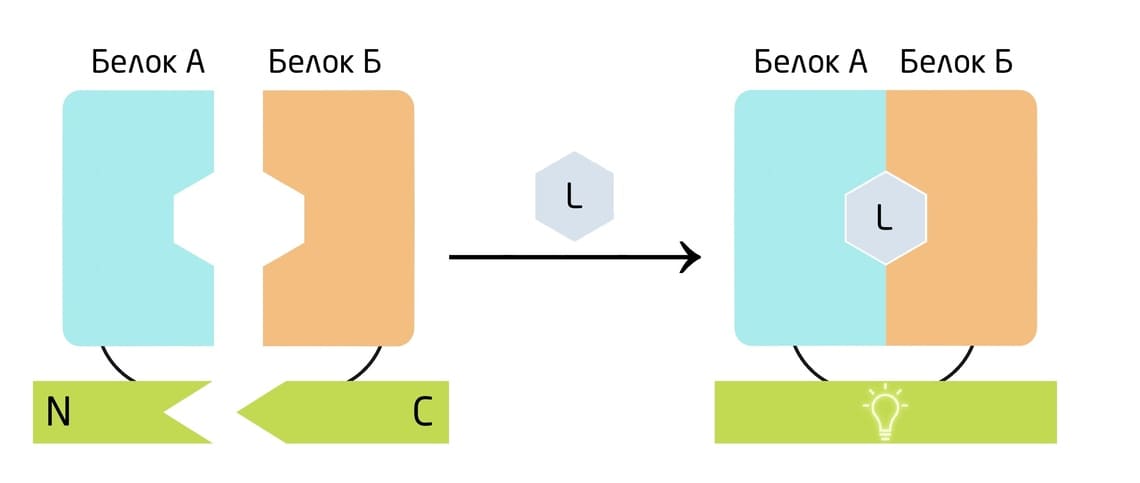
Разные люциферазы, особенно небольшие и не требующие кофакторов Gluc и NanoLuc, нашли применение в изучении белок-белковых взаимодействий. Люцифераза разделяется на 2 части, одна из которых состоит из N-концевого, а другая из С-концевого домена. Интересующие белки помечаются этими половинками. При добавлении лиганда изучаемые белки объединяются при взаимодействии, и оба конца люциферазы оказываются в непосредственной близости друг от друга, тем самым восстанавливая репортерную функцию люциферазы (Рис. 5). 11
Рис. 5. Схема использования люцифераз для изучения белок-белковых взаимодействий.
Ряд преимуществ для отдельных областей исследований имеют секретируемые люциферазы. С их помощью изучают клеточные пути секреции, межклеточную коммуникацию и сигналинг. 4, 12
Свет от биолюминесценции используется в клинической практике в качестве локализованного и регулируемого источника света для возбуждения фотосенсибилизаторов в фотодинамической терапии. 13 Молекулы фотосенсибилизатора, активированные светом, генерируют радикалы активных форм кислорода, которые могут разрушать белки и ткани. Высокая цитотоксичность может быть полезной в тех случаях, когда требуется гибель клеток в качестве терапии, например, при инфекциях и в онкологии.
Биолюминесцентную реакцию можно использовать для воздействия на другие процессы или управления ими, например, в области оптогенетики, где реакция биолюминесценции успешно заменяет внешние источники света, которые используются для контроля фотоактивных белков, ионных каналов и даже целых клеток, таких как нейроны. 14
Биолюминесцентные системы очень чувствительны к изменению условий реакции. Исследователи использовали свойство для создания аналитических методов для измерения различных параметров, таких как рН, концентрации ионов металлов, глюкозы, ферментов и молекул лекарственных средств, активных форм кислорода и т.д. 2, 3
Поскольку АТФ является необходимым кофактором в механизме биолюминесценции светлячков, пара Fluc и D-люциферин была адаптирована для детектирования молекул АТФ. Такие сенсоры используются для гигиенического контроля – проверки чистоты поверхностей в медицинских учреждениях, анализе питьевой воды, а также в молочной, рыбо- и мясоперерабатывающей промышленности. Быстрый и точный анализ на основе биолюминесцентного детектирования АТФ позволяет обнаружить в образцах наличие живых организмов, в том числе патогенных бактерий. 15 Высокая чувствительность и щадящая техника анализа позволяет использовать АТФ-сенсоры для оценки уровня бактерий, плесени, дрожжей, лишайников на старинных произведениях искусства для оценки областей, требующих повышенного внимания в ходе реставрации.
Биолюминесцентные сенсоры на основе светящихся бактерий используются в токсикологическом анализе и экомониторинге. Преимущество бактерий заключается в том, что их светоотдачу можно использовать в качестве меры выживаемости. Такие сенсоры применяются для анализа широкого спектра загрязняющих веществ, включая примеси тяжелых металлов и токсичные органические соединения, такие как толуол и нафталин. 16 Люминесцентные бактерии используются в пищевой промышленности для контроля выживаемости бактерий, например, в производстве йогуртов для улучшения условий культивирования промышленных штаммов бактерий. На люминесцентных бактериях также тестируют дезинфицирующие средства.
Мы описали только самые известные и интересные области применения биолюминесцентных систем. Но можно также упомянуть изучение циркадных ритмов 17; биовизуализацию физиологических процессов (например, прогрессии опухолей, развития инфекций) в масштабе целых, но некрупных организмов, таких как мыши 18; высокопроизводительные скрининги, тестирование антибиотиков, ингибиторов и лекарственных препаратов 19; иммунологические исследования 20; создание автономно светящихся организмов, например, растений 21; использование в искусстве и декоре и т.д. Системы биолюминесценции на основе различных природных механизмов имеют на сегодняшний день огромное научное и практическое значение, и их потенциал еще далеко не исчерпан.
Литература
1. Delroisse J. et al. Leaving the Dark Side? Insights Into the Evolution of Luciferases. Frontiers in Marine Science, 2021.
2. Syed A.J., Anderson J.C. Applications of bioluminescence in biotechnology and beyond. Chemical Society Reviews, 2021.
3. Kaskova Z.M., Tsarkova A.S., Yampolsky I.V. 1001 lights: luciferins, luciferases, their mechanisms of action and applications in chemical analysis, biology and medicine. Chemical Society Reviews, 2016.
4. Fleiss A., Sarkisyan K.S. A brief review of bioluminescent systems (2019). Current Genetics, 2019.
5. Котлобай А.А., Каськова З.М., Ямпольский И.В. Палитра люцифераз: природные инструменты для новых методов в биомедицине. Acta Naturae, 2020.
6. Thorne N., Inglese J., Auld D.S. Illuminating insights into firefly luciferase and other bioluminescent reporters used in chemical biology. Chemistry & Biology, 2010.
7. Widder E.A. Bioluminescence in the ocean: origins of biological, chemical, and ecological diversity. Science, 2010.
8. Brodl E., Winkler A., Macheroux P. Molecular Mechanisms of Bacterial Bioluminescence. Computational and Structural Biotechnology Journal, 2018.
9. Kotlobay A.A. et al. Genetically encodable bioluminescent system from fungi. Proceedings of the National Academy of Sciences of the USA, 2018.
10. Smale T.S. Luciferase Assay. Cold Spring Harbor Protocols, 2010.
11. Azad T., Tashakor A., Hosseinkhani S. Split-luciferase complementary assay: applications, recent developments, and future perspectives. Analytical and Bioanalytical Chemistry, 2014.
12. Badr C.E., Hewett J.W., Breakefield X.O., Tannous B.A. A highly sensitive assay for monitoring the secretory pathway and ER stress. PLoS One, 2007.
13. Hsu C.Y. et al. Bioluminescence resonance energy transfer using luciferase-immobilized quantum dots for self-illuminated photodynamic therapy. Biomaterials, 2013.
14. Love A.C., Prescher J.A. Seeing (and Using) the Light: Recent Developments in Bioluminescence Technology. Cell Chemical Biology, 2020.
15. Efremenko E. et al. Luminescent Analysis of ATP: Modern Objects and Processes for Sensing. Chemosensors, 2022.
16. Su L., Jia W., Hou C., Lei Y. Microbial biosensors: a review. Biosensors and Bioelectronics, 2011.
17. Ramanathan C. et al. Monitoring cell-autonomous circadian clock rhythms of gene expression using luciferase bioluminescence reporters. Journal of Visualized Experiments, 2012.
18. Yao Z., Zhang B.S., Prescher J.A. Advances in bioluminescence imaging: new probes from old recipes. Current Opinion in Chemical Biology, 2018.
19. Thorne N., Auld D.S., Inglese J. Apparent activity in high-throughput screening: origins of compound-dependent assay interference. Current Opinion in Chemical Biology, 2010.
20. Wu C., Irie S., Yamamoto S., Ohmiya Y. A bioluminescent enzyme immunoassay for prostaglandin E(2) using Cypridina luciferase. Luminescence, 2009.
21. Khakhar A. et al. Building customizable auto-luminescent luciferase-based reporters in plants. eLife, 2020.




.jpg)