Медиатека
«Клик»-химия и биоортогональная химия. Часть 1: принципы, объекты и мишени
Оглавление:
•
Биоортогональная химия
•
Основные принципы и реакции БОХ
•
Методы БОХ: что, чем и как маркировать?
«Клик»-химия – новая концепция синтеза органических молекул путём мгновенного, «по щелчку» (от англ. click), соединения отдельных молекулярных блоков, при котором не образуется побочных продуктов, а гетероатомные молекулярные системы получаются с высоким выходом и в мягких условиях.
Один из основателей «клик»-химии, американский химик, дважды нобелевский лауреат – Барри Шарплесс – сформулировал основные требования к органическим реакциям нового типа 1:
- Реакция должна быть модульной, быстрой, стереоспецифичной и протекать в простых условиях.
- Реакция должна проходить с максимально высоким выходом основного продукта и с простой последующей экстракцией продукта.
- В реакции могут генерироваться только безвредные побочные продукты, которые можно легко удалить.
- Исходные реагенты и материалы должны быть широкодоступными.
- Использование мягких растворителей (например, воды) или отсутствие растворителя, нечувствительность к воде и кислороду.
Среди огромного многообразия реакций органического синтеза была найдена реакция, которая в большей мере соответствовала описанным требованиям, – образование циклического соединения при взаимодействии алкинов (соединения с тройной связью между атомами углерода) с азидами (молекулами, имеющими химическую группу N=N=N). Она была открыта Артуром Михаэлем в 1983 году (Рис. 1). Однако при низкой скорости реакции в жёстких условиях (сутки при 120°С) выход основного продукта был неэффективным.
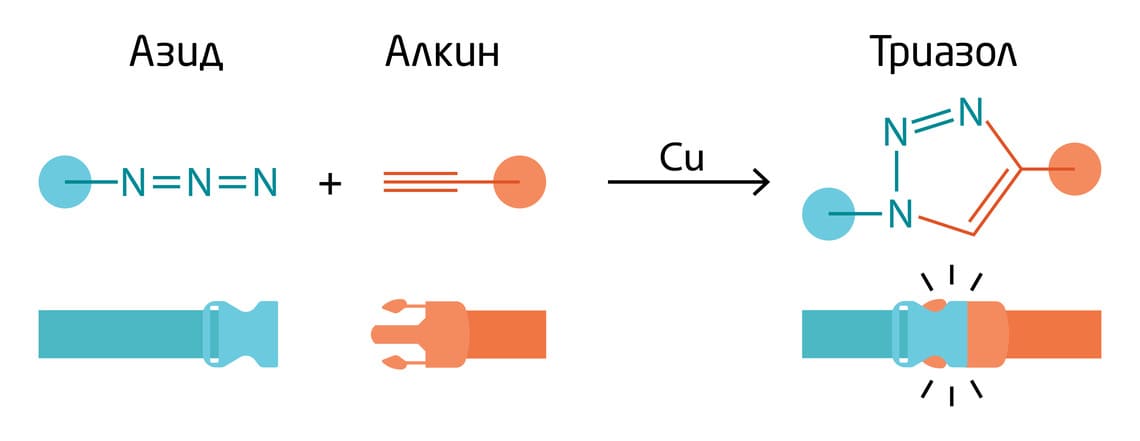
Рис. 1. Общий принцип «клик»-химии на примере взаимодействия азидов и алкинов с образованием циклического соединения.
Заслуга Шарплесса и его коллег состояла в том, что они подобрали катализаторы (соединения меди), в присутствии которых реакция проходила в водной среде практически мгновенно и не давала побочных продуктов. Эта реакция, известная как азид-алкиновое циклоприсоединение, катализируемое медью (CuAAC, Cu-catalyzed azide-alkyne cycloaddition), положила начало направлению «клик»-химии и стала её «золотым стандартом». 2
Суть «клик»-реакций состоит в том, что высоко реакционноспособные фрагменты, к которым, например, относятся алкины и азиды, способны взаимодействовать между собой, будучи встроенными в структуру различных молекул. Таким образом они обеспечивают функцию их «сшивания», которое в условиях отсутствия реакционноспособных фрагментов невозможно или требует реализации многостадийного процесса со значительным выходом побочных продуктов реакции.
Базово к «клик»-реакциям относятся следующие (Рис. 2) 3:
- Циклоприсоединения – в основном 1,3-диполярные и циклоприсоединения Дильса.
- Нуклеофильное раскрытие колец напряжённых гетероциклических электрофилов, таких как азиридины, эпоксиды, циклические сульфаты, ионы азиридиния и ионы эписульфония.
- Карбонильная химия неальдольного типа, включающая образование мочевин, тиомочевин, гидразонов, простых эфиров оксимов, амидов, ароматических гетероциклов и т.д.
- Присоединения к углерод-углеродным кратным связям, такие как эпоксидирование, азиридинирование, дигидроксилирование, присоединение сульфенилгалогенидов, присоединения нитрозилгалогенидов и некоторые реакции Михаэля.
«Клик»-химия стала популярным подходом в разных областях благодаря простоте, универсальности, однонаправленности реакций и мягким условиям. Методы «клик»-химии активно применяют в физике, биологии и науках о материалах – от модификации живых организмов и лечения рака до разработки материалов, используемых в преобразователях энергии Солнца. С точки зрения реализации применения «клик»-химии для изучения биологических систем были разработаны подходы, которые получили название биоортогональная химия.
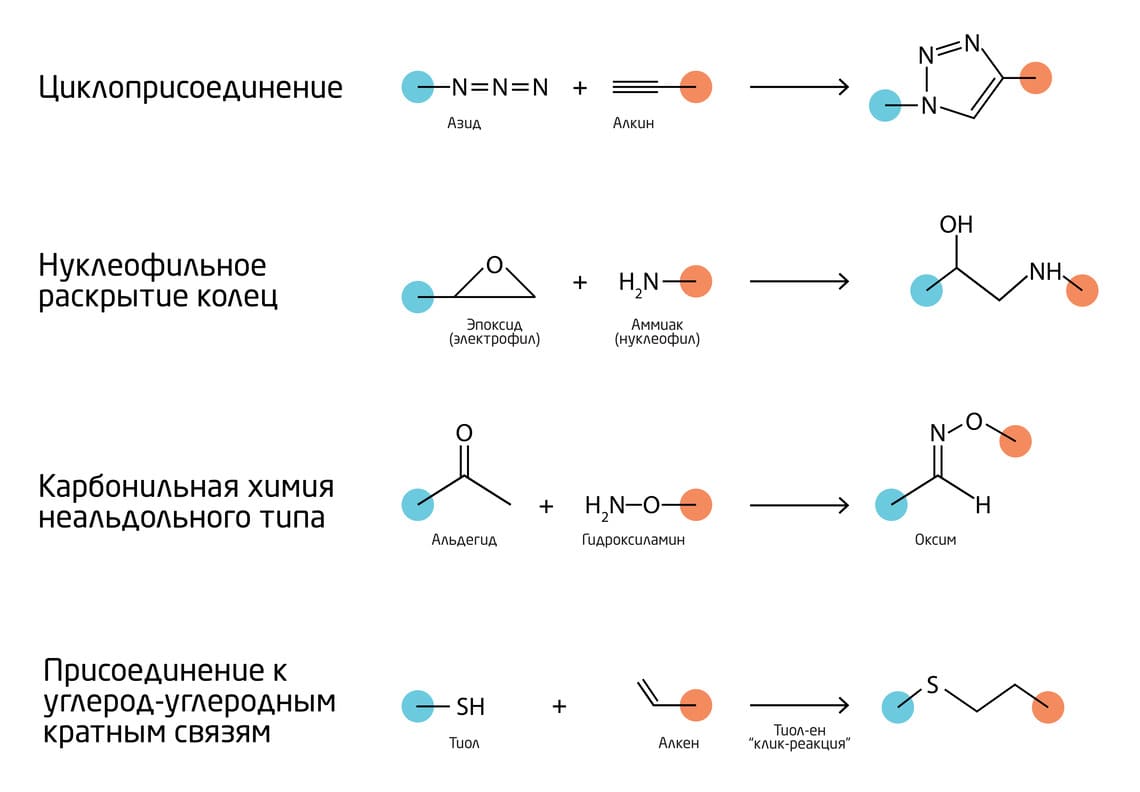
Рис. 2. Основные типы «клик»-реакций.
Биоортогональная химия
Это направление химии представляет собой набор методов, использующих реакционную способность ненативных функциональных групп для изучения живых систем и организмов. Биоортогональные реакции протекают в биологической среде без влияния на другие молекулы, биохимические процессы и эндогенные функциональные группы молекул.
Термин был придуман исследовательской группой Каролин Бертоцци и происходит от математической концепции «ортогональности», используемой для описания двух объектов, которые изменяются независимо друг от друга. За 20 лет, прошедших с момента её создания, биоортогональная химия (БОХ) стала важной методологией биологических исследований. В 2022 году К. Бертоцци, М. Мелдал и Б. Шарплессу была присуждена Нобелевская премия по химии за разработку «клик»-химии и работы в области биортогональной химии.
Основные принципы и реакции БОХ
Благодаря БОХ можно исследовать биологические системы посредством ковалентных модификаций биомолекул неприродными функциональными группами, что позволяет их изучать и манипулировать ими. С помощью БОХ можно модифицировать или пометить широкий набор биомолекул, включая белки, нуклеиновые кислоты, сахара и липиды. По сути это органический синтез в живых клетках и организмах, и это налагает ряд требования для такого типа реакций: хемоселективность (реакция должна протекать селективно между используемыми функциональными группами без побочных процессов с участием других биомолекул), нетоксичность, оптимальная скорость реакции при низких концентрациях, водная среда, а также биосовместимые pH и температура. 4
Понимание лежащих в основе БОХ физико-химических процессов – важная составляющая применения БОХ, которая активно изучается научным сообществом. 5, 6 В нашей статье мы ограничимся лишь перечислением основных типов реакций биоортогональной химии без углубления в их механизмы:
- нативное химическое лигирование;
- лигирование Штаудингер;
- обратная реакцию Дильса-Альдера;
- лигирование оксимов и гидразонов;
- катализируемое медью азид-алкиновое циклоприсоединение;
- реакции лигирования тетразина и тетразола;
- фотоиндуцируемые биоортогональные реакции и т.д.
Более подробно мы остановимся непосредственно на участниках и мишенях биоортогональных реакций.
Биоортогональная реакция обычно состоит из 2-х этапов. Сначала биомолекулу (субстрат) модифицируют биоортогональной функциональной группой и вводят в клетку. После этого в систему вводят метку, которая содержит комплементарную функциональную группу. В результате происходит мечение субстрата.
Присутствие меди в классической реакции CuAAC не позволяет использовать её для биологических исследований из-за токсичности ионов меди. Группа К. Бертоцци модифицировала подход, разработав азид-алкиновое циклоприсоединение, промотируемое напряжением цикла (SPAAC, Strain-promoted azide-alkyne cycloaddition), в основе которого лежит повышение реакционной способности алкина (напряженного циклооктина). 7 Такой подход позволил ускорить классическую реакцию циклоприсоединения в отсутствие токсичного медного катализатора, что открыло возможность использования этой реакции в живых системах и сделало её биоортогональной (Рис. 3).
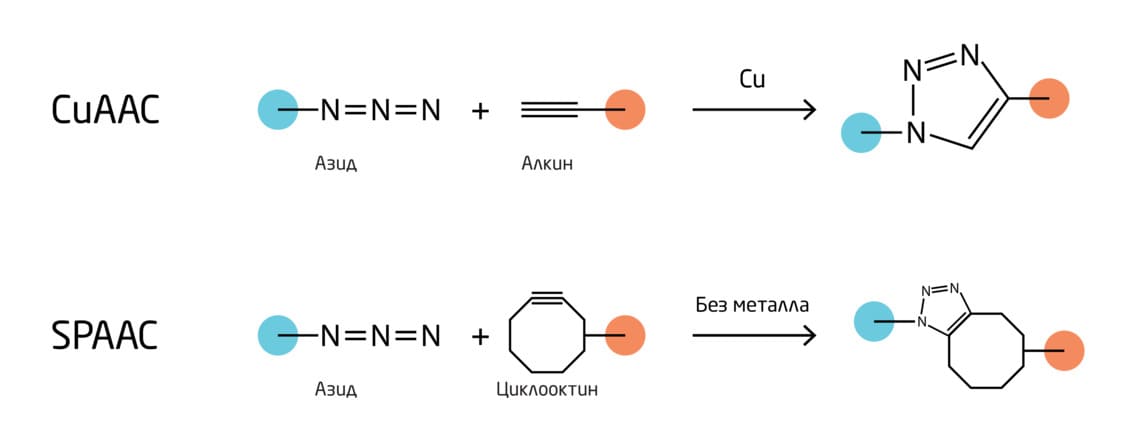
Рис. 3. Схема классической «клик»-реакции и реакции азид-алкинового циклоприсоединения, промотируемого напряжением цикла (SPAAC).
На сегодняшний день наиболее известными биоортогональными репортёрами для селективного мечения биомолекул являются альдегиды и кетоны, азиды, алкены и алкины, нитроны, тиолы и тетразолы. При этом уникальность алкинов, азидов и триазолов заключается в том, что они отсутствуют в живых организмах и не участвуют в эндогенных биохимических процессах. Если в природное соединение ввести ацетиленовый фрагмент, то органический азид будет избирательно взаимодействовать только с ним.
Методы БОХ: что, чем и как маркировать?
1. Белки
Распространённость и центральная роль белков в биологических процессах делают их желанной мишенью для маркировки, в том числе с помощью методов БОХ. Например, можно вставлять неканонические аминокислоты, несущие функциональные группы для последующих биоортогональных реакций.
Существует 2 основных подхода к включению неканонических аминокислот: аминокислот-специфичный и сайт-специфичный (Рис. 4). При аминокислот-специфичном включении неприродная аминокислота может заменить в белке любую природную аминокислоту. Часто это бывают структурные аналоги, которые могут служить субстратом для тРНК-синтетазы природной аминокислоты. Добавление неканонических аминокислот в культуральную или реакционную среду в соответствующих условиях приводит к включению их в белки клетки. При этом вставка не является сайт- или белок-специфичной. Данный подход используется в протеомных исследованиях, поскольку позволяет маркировать, визуализировать и потенциально идентифицировать многие элементы протеома. Конкретными примерами таких аминокислот являются селенометионин, азидогомоаланин, гомопропаргилглицин и гомоаллилглицин. 4
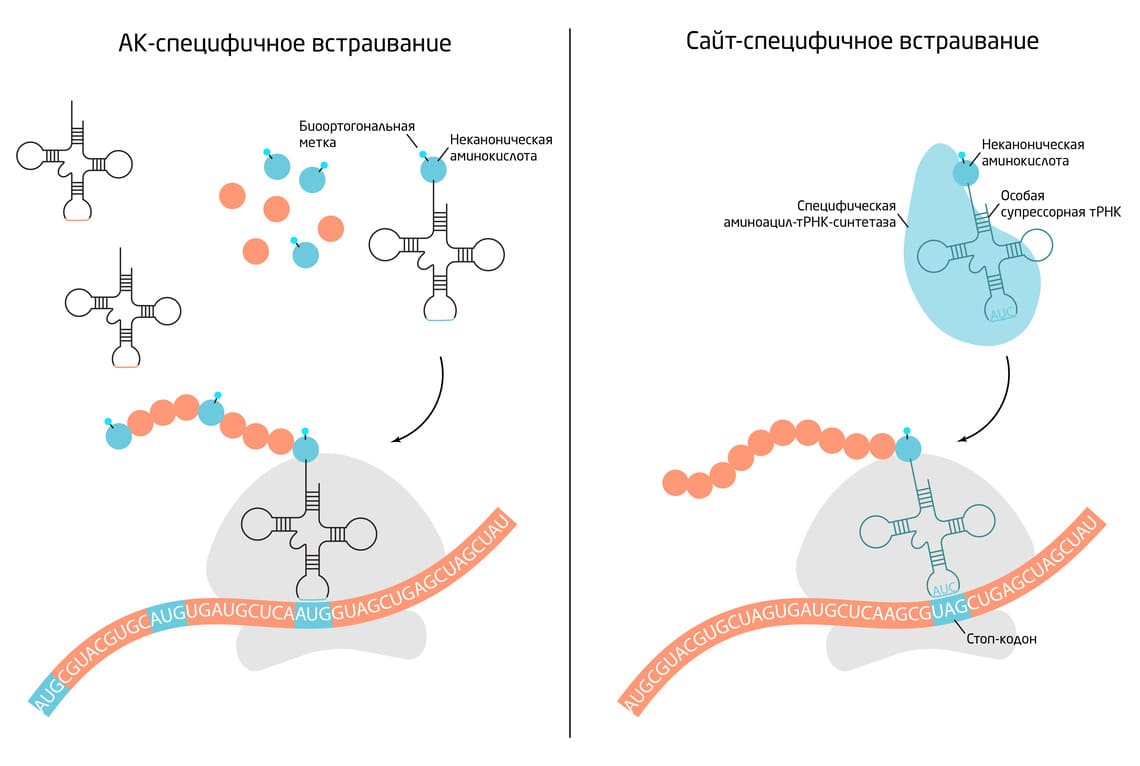
Рис. 4. Основные подходы к включению неканонических кислот в белки.
Сайт-специфичное включение нацеливает неканоническую аминокислоту на конкретное место в белке. Для этого подхода используют модифицированную систему трансляции, основанную на использовании особой супрессорной тРНК. Обычно трансляция прекращается, когда рибосома встречает стоп-кодон на мРНК. В модифицированной системе специфическая тРНК-синтетаза распознает супрессорную тРНК и заряжает её неканонической аминокислотой. Во время трансляции эта аминокислота встраивается в полипептид, когда рибосома считывает стоп-кодон. Последовательность стоп-кодона в свою очередь можно ввести методами генной инженерии. 8
Помимо метаболического включения биоортогональные метки можно добавлять пост-трансляционно, применяя энзиматическое мечение с использованием различных пептидаз, трансфераз, лигаз и пероксидаз, а также включать в состав самомаркирующихся белков и пептидов.
Пример посттрансляционной маркировки – ацетилирование доступных остатков лизина ферментом лизинацетилтрансферазой. При этом биоортогональные метки могут быть включены в субстраты ацетил-КоА или ацил-КоА, которые используются для ацетилирования или ацилирования белка (Рис. 5). 9
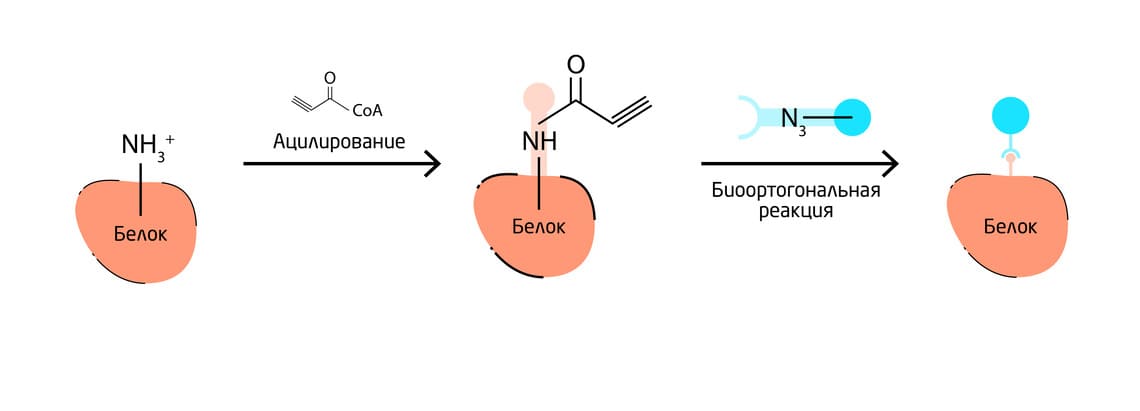
Рис. 5. Основные подходы к включению неканонических кислот в белки. Схема посттрансляционной маркировки белков с помощью ацетилирования.
Тубулин-тирозинлигаза (ТТЛ) катализирует присоединение производных тирозина к С-концевой карбоновой кислоте белка. Фермент связывается с последовательностью из 14 аминокислот, называемой Tub-tag, и позволяет вводить производные тирозина, обладающие уникальным химическим составом (Рис. 6). 10
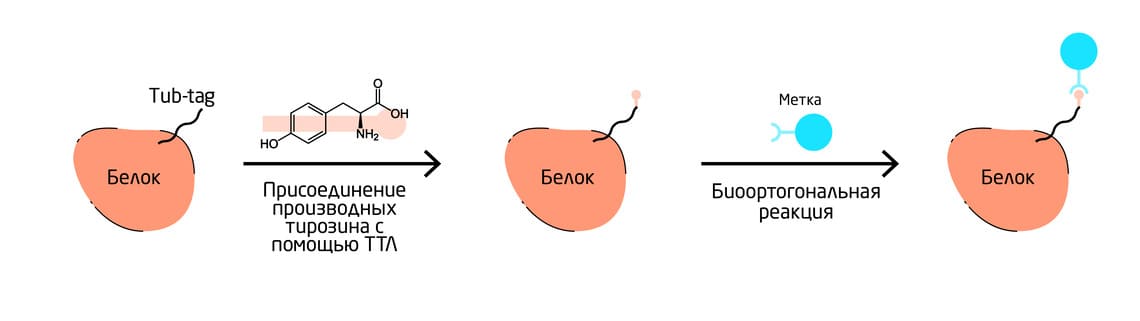
Рис. 6. Схема процесса присоединения производных тирозина к белку.
Биотинлигаза BirA биотинилирует остаток лизина в пределах акцепторного пептида биотина (АПБ). Белки, тэгированные АПБ-узнающим мотивом, могут быть селективно биотинилированы. BirA может принимать кетон, содержащий аналог биотина – кетобиотин – в качестве субстрата. После ферментативного переноса на интересующий белок кетобиотин может быть ковалентно помечен гидразидами, гидроксил-аминами или алкоксиаминами (Рис. 7). 11
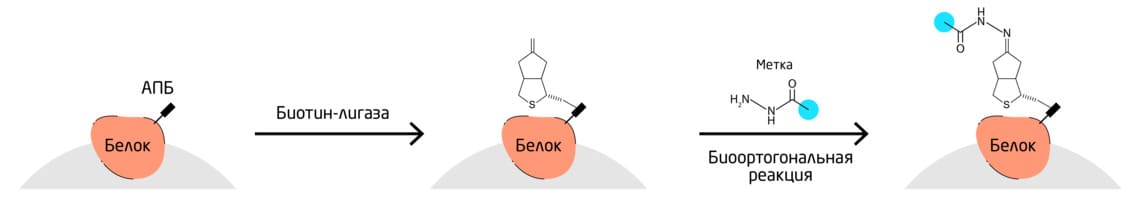
Рис. 7. Схема селективного биотинилирования белков.
Самомаркирующиеся белковые метки/тэги представляют собой небольшие пептиды, предназначенные для ковалентной конъюгации с низкомолекулярными зондами, которые могут нести биоортогональный линкер. Самомаркирующиеся ферменты и белки напрямую присоединяют субстраты и реагенты к аминокислоте или функциональной группе в своей структуре, а не к экзогенной биомолекуле-мишени (Рис. 8). В этих случаях сам пептид служит репортёром и часто экспрессируется в виде гибрида с интересующим белком – «фьюжн-белка». Например, Halo-Tag, CLIP-tag и SNAP-Tag. SNAP-tag необратимо реагирует с производными O⁶-бензилгуанина, CLIP-tag с производными O²-бензилцитозина, а Halo-tag – с первичными алкилгалогенидами, такими как алкилхлориды. 12, 13
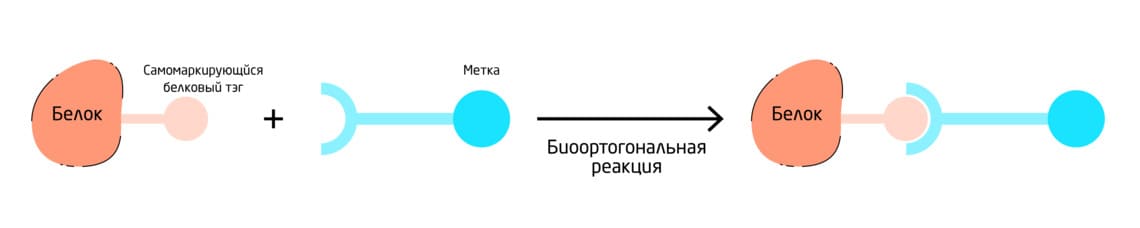
Рис. 8. Схема работы самомаркирующихся белковых меток.
2. Нуклеиновые кислоты
Мечение нуклеиновых кислот (НК) требуется для многих исследований, направленных на выяснение их функций, динамики in vitro и в живых клетках. Из многочисленных концепций маркировки ковалентное мечение обеспечивает самую стабильную связь, непревзойдённый выбор компактных и специфичных меток, а также их универсальность. 14
Введение биоортогональных меток в НК возможно с помощью химических методов, химико-ферментативных стратегий и рибозимы, а также метаболического (по мере биосинтеза) мечения нуклеиновых кислот. Процесс введения метки подразделяется на прямую (или одноэтапную) и двухэтапную маркировку, которая подразумевает ко-синтетическое включение функциональной группы и последующее мечение с помощью «клик»-химии (Рис. 9).
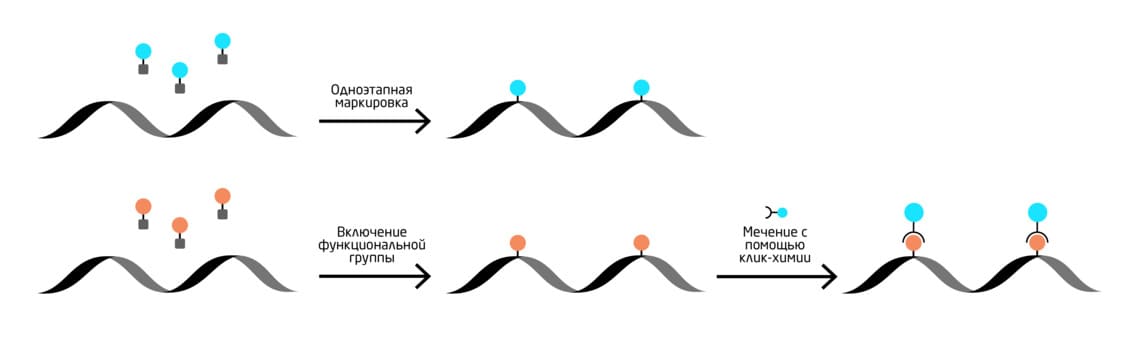
Рис. 9. Схема мечения нуклеиновых кислот с использованием биоортогональных меток. Наверху – одноэтапная маркировка, внизу – двухэтапная маркировка.
Флуоресцентное мечение НК – самая распространённая модификация. К настоящему моменту доступен широкий набор флуоресцентных аналогов нуклеотидов, нуклеозидов и отдельных азотистых оснований. Тем не менее, не все они используются в биоортогональной химии и применимы для изучения живых систем.
Для биоортогонального мечения, преимущественно флуоресцентного, используют азид-модифицированные нуклеозидтрифосфаты, которые встраиваются в структуру РНК, например, 5-Винилуридин (VU), этинил-уридин (EU) или остов ДНК, обеспечивая биоортогональные метки для дальнейшей маркировки, такие как, 2`-азидо-2`-дезоксиаденозин (2`-azA), 5-(азидометил)-2`-дезоксиуридин (AmdU), 5-бромо-2'-дезоксиуридин(BrdU) и т.д. Алкенилдезоксинуклеозиды и алкинилнуклеозиды используют для маркировки нуклеиновых кислот, например, аналог тимидина 5-этинил-20-дезоксиуридин (EdU), 5-винил-2′-дезоксиуридин (VdU), 2’-дезокси-2’-фтор-5-этинилуридин (F-ara-EdU), этинил-аденозин (EA) и другие. 14
Один из подходов включает в себя прикрепление биоортогональных реакционных меток к концам антисмысловых олигонуклеотидов. Эти олигонуклеотиды гибридизуются с мишенью таким образом, что биоортогональная реакционная пара становится достаточно близкой для реакции. Это приводит к флуоресценции. В данной системе используется лигирование тетразина: один компонент несёт флуорофор, который гасится тетразиновым фрагментом; циклоприсоединение удаляет тетразиновый гаситель и активирует флуоресценцию (Рис. 10). 15
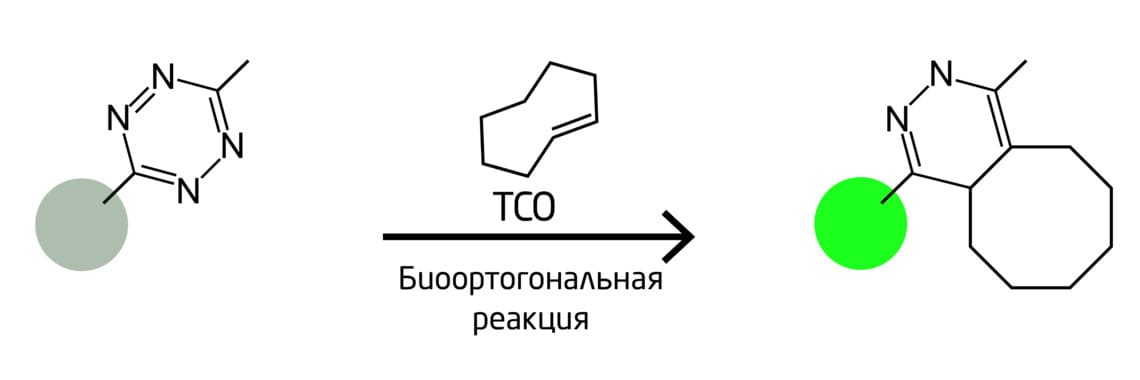
Рис. 10. Схема биоортогонального мечения гибридизацией антисмысловых олигонуклеотидов и мишени.
Перспективным направлением является метаболическое мечение ДНК, селективное по типу клеток. Этот способ можно использовать для визуализации инфицированных патогенами клеток, что уже было продемонстрировано на клетках, инфицированных вирусом простого герпеса. В работе использовали аналог одного из метаболитов, 20-дезокси-20,20-дифтор-5-этинилуридин (dF-EdU), фосфорилирование которого зависит от тимидинкиназы вируса герпеса и не катализируется ферментом человека. 16
3. Полисахариды
Полисахариды, или гликаны, играют жизненно важную роль – они связаны с белками и липидами, участвуют в биологических процессах на клеточной поверхности и внутри клеток. Гликаны не закодированы генетически, их нельзя изучить с помощью стандартных методов молекулярной биологии. Поэтому возможность маркировки гликанов биоортогональными метками вызвала большой интерес учёных.
Такие метки внедряются в биологическую систему в форме модифицированных неприродных моносахаридов – предшественников гликанов. Эти молекулы имеют реакционную группу, которая достаточно мала, чтобы быть принятой клеточным метаболическим механизмом, но в то же время инертна по отношению к естественным биохимическим процессам.
Например, аналоги N-ацетилманнозамина – N-левулиноилманнозамин, N-азидоацетилманнозамин (Ac4ManNAz) и N-(4-пентиноил)маннозамин эффективно включаются в гликаны позвоночных с использованием метаболического пути биосинтеза сиаловой кислоты. Аналоги N-ацетилглюкозамина (Ac4GlcNAz) и N-ацетилгалактозамина (Ac4GalNAz) также успешно встраиваются в гликаны. С меньшей эффективностью встраиваются аналоги алкиновых сахаров. После включения не природных моносахаридов такие модифицированные гликаны поддаются биоортогональным реакциям. 4
4. Липиды
Липиды живых организмов – также непростые для исследования биомолекулы, но реакции БОХ дали хороший стимул для их изучения. Исследователи получили биоортогонально функциональные аналоги нескольких видов липидов, включая жирные кислоты, стеролы, фосфолипиды и сфинголипиды. Многие из используемых аналогов несут азидные или алкиновые реакционноспособные группы, которые впоследствии могут быть модифицированы репортёрными группами или красителями.
Аналоги жирных кислот являются важными зондами для липидомики и отслеживания метаболизма жирных кислот, а также используются для изучения посттрансляционной модификации белков липидами. Проблема с использованием аналогов жирных кислот заключается в том, что они вводятся в состав многочисленных типов липидов, что приводит к снижению специфичности маркировки. Примерами являются азидоэтилхолин, пропаргилхолин и 6-гексин-1-ол. Они используются для мечения фосфатидилхолинов и фосфатидных кислот. 4
Биоортогональная химия и маркировка биомолекул – быстро развивающаяся область науки, которая объединяет несколько направлений исследований в области биофизики, органической химии, биохимии и биологии. В данной статье мы рассмотрели основные принципы, объекты и мишени БОХ. В следующем материале мы подробнее расскажем о направлениях исследований, в которых применяются реакции БОХ, а также рассмотрим интересные примеры. Оставайтесь с нами!
Литература
1. Kolb H.C., Finn M.G., Sharpless K.B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angewandte Chemie International Edition, 2001.
2. Левицкий М.М., Перекалин Д.С. Не почивать на лаврах [о новых направлениях в химии]. Химия и жизнь, 2012.
3. Казыбаева Д.С., Ирмухаметова Г.С.,Хуторянский В.В. Тиол-ен «Клик-реакции» как перспективынй путь получения полимерных материалов. Высокомолекулярные соединения (серия Б), 2022.
4. Bird R.E., Lemmel S.A., Yu X., Zhou Q.A. Bioorthogonal Chemistry and Its Applications. Bioconjugate Chemistry, 2021.
5. Scinto S.L. et al. Bioorthogonal chemistry. Nature Reviews Methods Primers, 2021.
6. Sletten E.M., Bertozzi C.R. From mechanism to mouse: a tale of two bioorthogonal reactions. Accounts of Chemical Research, 2011.
7. Baskin J.M. et al. Copper-free click chemistry for dynamic in vivo imaging. Proceedings of the National Academy of Sciences of the United States of America, 2007.
8. Dumas A., Lercher L., Spicer C.D., Davis B.G. Designing logical codon reassignment - Expanding the chemistry in biology. Chemical Science, 2015.
9. Song J., Zheng Y.G. Bioorthogonal Reporters for Detecting and Profiling Protein Acetylation and Acylation. SLAS Discovery, 2020.
10. Gerlach M. et al. Tubulin Tyrosine Ligase-Mediated Modification of Proteins. Methods in Molecular Biology, 2019.
11. Chen I., Howarth M., Lin W., Ting A.Y. Site-specific labeling of cell surface proteins with biophysical probes using biotin ligase. Nature Methods, 2005.
12. Reymond L. et al. Visualizing biochemical activities in living cells through chemistry. Chimia (Aarau), 2011.
13. Hoelzel C.A, Zhang X. Visualizing and Manipulating Biological Processes by Using HaloTag and SNAP-Tag Technologies. ChemBioChem, 2020.
14. Klöcker N., Weissenboeck F.P., Rentmeister A. Covalent labeling of nucleic acids. Chemical Society Reviews, 2020.
15. Wu H., Devaraj N.K. Advances in Tetrazine Bioorthogonal Chemistry Driven by the Synthesis of Novel Tetrazines and Dienophiles. Accounts of Chemical Research, 2018.
16. Neef A.B. et al. A Bioorthogonal Chemical Reporter of Viral Infection. Angewandte Chemie International Edition, 2015.




.jpg)
























