- Главная страница
- Медиатека
- Информационные статьи
- Искусственный интеллект поможет улучшить качество ЭКО: поддержка компании «Хеликон»
Медиатека
По данным ВОЗ 1, около 186 миллионов человек в мире страдают бесплодием. Одной из наиболее распространенных причин нарушения фертильности является длительное течение воспалительных заболеваний органов малого таза (в том числе вызванных инфекцией Chlamydia trachomatis, которое приводит к повреждению маточных труб (например, непроходимость или спайки) и делает невозможным естественное оплодотворение. 2, 3 В этом случае решением становится экстракорпоральное оплодотворение (ЭКО).
Процедура ЭКО включает пять основных этапов: получение яйцеклеток и сперматозоидов, оплодотворение in vitro, выращивание эмбриона и, наконец, введение его в полость матки. Сначала яичники стимулируют с помощью так называемых индукторов суперовуляции (фолликулостимулирующий и лютеинизирующий гормоны, хорионический гонадотропин, регуляторы гонадотропин-рилизинг гормона и др.). 4 Созревшие яйцеклетки извлекают и помещают в чашку Петри, где происходит их оплодотворение и последующая культивация в строго контролируемых условиях. 2 После определения стадии развития проводят отбор и перенос эмбриона непосредственно в матку. Это происходит на самом раннем, преимплантационном этапе развития, на стадии бластоцисты (первое морфологически дифференцированное состояние) спустя 5-6 дней после оплодотворения. 2
Высокая субъективность или предвзятость в интерпретации данных остается главным недостатком современных методов ЭКО, ведь в большинстве случаев морфологические характеристики эмбриона определяют с помощью «простого» визуального осмотра. Инвазивные методы, требующие криоконсервации, например, биопсия эмбриона и генетическое тестирование, применяются гораздо реже. 2, 5

Источник 1 >>,
источник 2 >>,
источник 3 >>
Преодолеть эти трудности позволяют технологии на основе методов искусственного интеллекта, например, компьютерное зрение и машинное обучение. 6 Именно их и использовали ученые при разработке усовершенствованного метода анализа и отбора цифровых изображений бластоцист, полученных на поздних этапах развития и имеющих различные технические характеристики (в зависимости от увеличения, типа камеры, освещения и т.д.). 7
В общей сложности исследователи проанализировал 592 микрофотографии, включая 372 изображения стадии экспансии (расширения) бластоцисты, 199 – стадии вылупления и 21 – выхода эмбриона из защитного слоя, zona pellucida («хетчинг») (Рис.1). Автоматическую сегментацию проводили одновременно в четырех регионах – центральной полости бластоцисты (бластоцель), внутренней клеточной массе (эмбриобласт), наружном слое клеток (трофэктодерма) и наружной блестящей оболочке (zona pellucida).
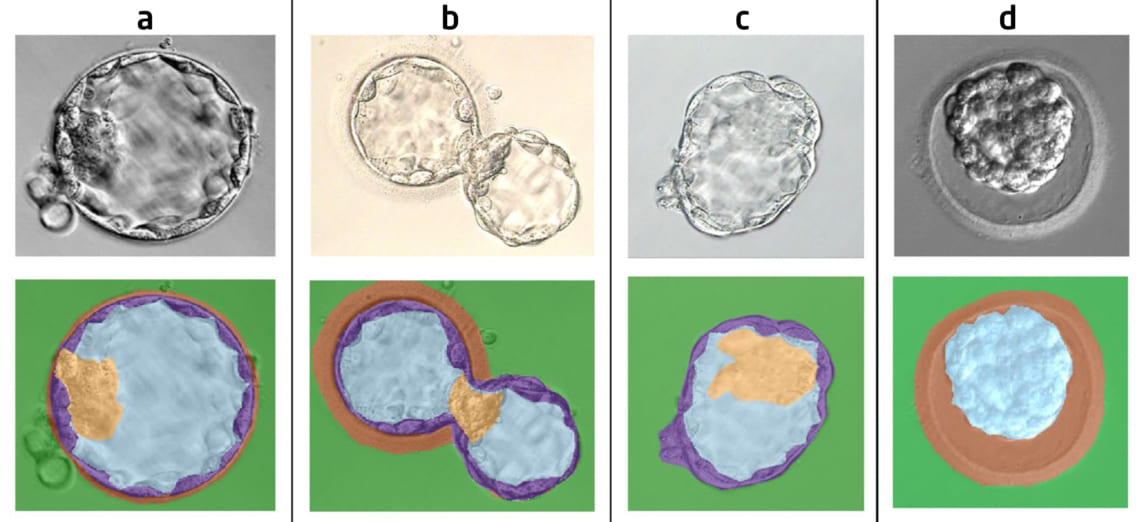
Рис. 1. Изображения бластоцисты на различных стадиях развития: (a) расширение; (b) вылупление; (c) хетчинг; (d) коллапс (уменьшение полости бластоцели и потеря части жидкости). Зеленый – фон; голубой – бластоцель; оранжевый – блестящая оболочка (zona pellucida); фиолетовый – трофэктодерма; желтый – эмбриобласт (внутренняя клеточная масса).
7
Точность предложенного метода была сопоставима с точностью сегментации опытным эмбриологом (Рис. 2). Точнее всего алгоритм определял бластоцель, в то время как наиболее трудной для сегментации и чувствительной к параметрам съемки областью оказался эмбриобласт (вероятно, из-за его оптического сходства в трофобластом).
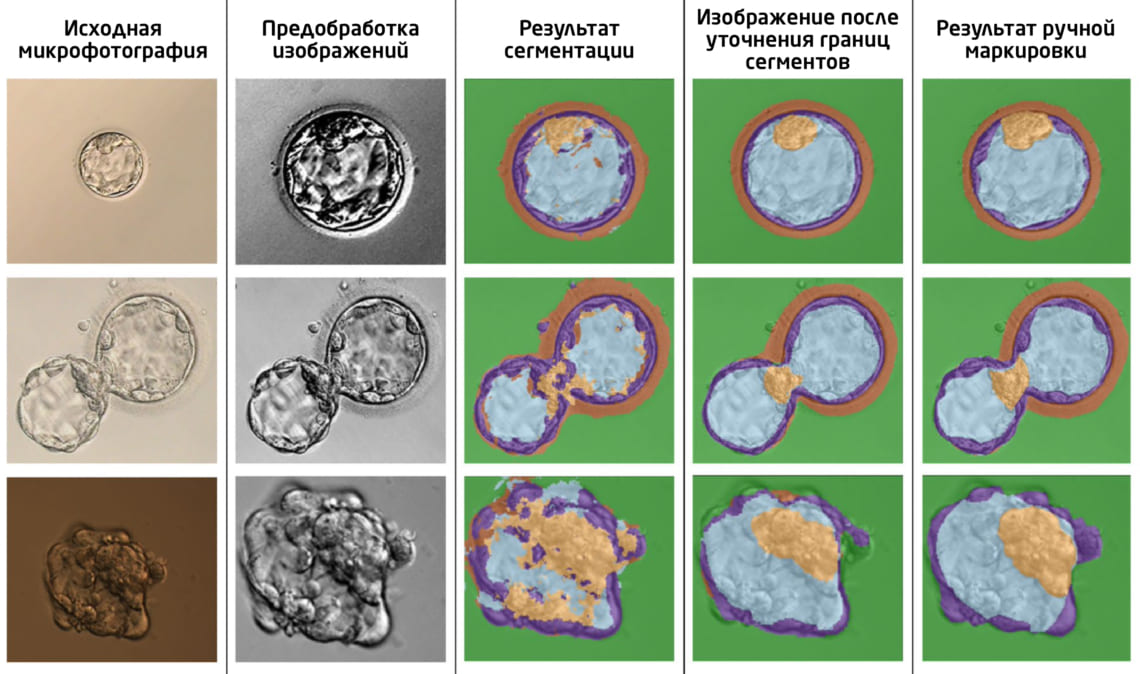
Рис. 2. Примеры микрофотографий бластоцисты после предварительной обработки, а также до и после уточнения границ сегментов с помощью ручной маркировки («ground truth image»). Зеленый – фон; голубой – бластоцель; оранжевый – блестящая оболочка (zona pellucida); фиолетовый – трофэктодерма; желтый – эмбриобласт (внутренняя клеточная масса).
7
Искусственный интеллект становится незаменимым помощником современного исследователя. Машинное обучение предоставляет ученому-эмбриологу принципиально новые подходы к анализу микроизображений биологических препаратов, помогая повысить объективность интерпретации данных и смягчить требования к качеству изображений. Хотя результаты исследования продемонстрировали высокую точность нового метода сегментации, обучение алгоритма проводилось на ограниченном наборе данных, а значит, предложенный подход требует дополнительной проверки перед его внедрением в широкую клиническую практику.
Литература
1. Infertility. World Health Organization.
2. Choe J., Shanks A.L. In Vitro Fertilization. StatPearls. Treasure Island (FL): StatPearls Publishing, 2022.
3. Abrao M.S., Muzii L., Marana R. Anatomical causes of female infertility and their management (https://europepmc.org/article/med/24119894). International Journal of Gynecology & Obstetrics, 2013.
4. Takeo T., Nakagata N. Superovulation Using the Combined Administration of Inhibin Antiserum and Equine Chorionic Gonadotropin Increases the Number of Ovulated Oocytes in C57BL/6 Female Mice. PLoS One, 2015.
5. Sugawara A., Ward M.A. Biopsy of embryos produced by in vitro fertilization affects development in C57BL/6 mouse strain. Theriogenology, 2013.
6. Esteva A. et al. Deep learning-enabled medical computer vision. NPJ Digital Medicine, 2021.
7. Farias A.FS. et al. Automated identification of blastocyst regions at different development stages. Scientific Reports, 2023.
Обложка: источник 1 >>, источник 2 >>




.jpg)
























