Медиатека
Адаптация без мутаций: что метилирование ДНК может рассказать об истории жизни морских рыб?
Можно ли на уровне отдельного организма изменить фенотип, не меняя при этом геном? Изменение генома в течение жизни, т.е. мутации, не самый надёжный способ повышения адаптивности организма. Чтобы изменить фенотип при быстро меняющихся условиях среды, природа предусмотрела «адаптацию без мутаций» – специальные молекулярные механизмы, например, эпигенетические модификации, позволяющие менять активность (т.е. экспрессию) и фенотипические проявления генов, не изменяя их нуклеотидную последовательность. Основным видом таких модификаций является метилирование. 1
Метилирование ДНК – это присоединение метильной (CH3) группы к пятому углероду цитозина (С) с образованием 5-метилцитозина (5mC) с помощью ДНК-метилтрансфераз (рис. 1). Чаще всего метилирование происходит в динуклеотидах CpG. ДНК-метилтрансферазы Dnmt3a и Dnmt3b катализируют метилирование цитозина de novo, в то время как метилтрансфераза Dnmt1 обеспечивает сохранение паттернов метилирования ДНК во время клеточного деления. В то время как у беспозвоночных частота метилирования относительно невысока (например, у Drosophila метилирован только ~1% генома), в эмбриональных стволовых клетках человека метилированы около 80% динуклеотидов CpG. 1, 2
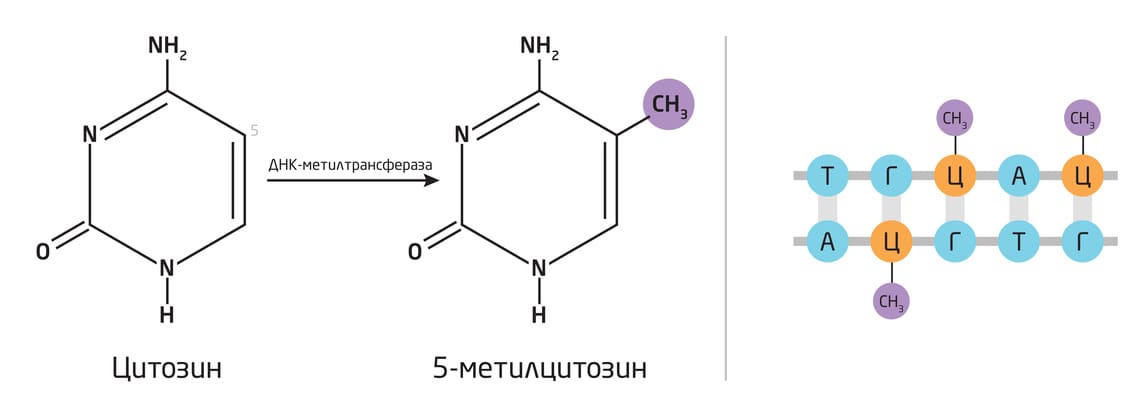 Рис. 1. Процесс метилирования ДНК с образованием 5-метилцитозина (5mC) с помощью ДНК-метилтрансфераз.
Рис. 1. Процесс метилирования ДНК с образованием 5-метилцитозина (5mC) с помощью ДНК-метилтрансфераз.
Эпигенетические модификации играют важную роль во множестве генетических процессов – подавлении транскрипции, инактивации Х-хромосомы, эмбриональном развитии, геномном импринтинге, изменении структуры хроматина и даже инактивации транспозонов. 1 Метилирование CpG-островков (CGI), расположенных в промоторных областях, может «выключать» гены, блокируя инициацию транскрипции и нарушая связывание белков с ДНК. Метилирование также может регулировать экспрессию повторяющихся элементов ДНК, контролировать сплайсинг (паттерн метилирования генов часто меняется на границах интронов и экзонов) и способствовать распознаванию экзонов белками (например, метил-CpG-связывающим белком MeCP2).
У некоторых растений метилирование CpG в транскрибируемых областях повышает транскрипцию генов, тогда как метилирование CHG (H обозначает любой из трёх нуклеотидов A, T или C), наоборот, подавляет этот процесс. Метилированию могут подвергаться даже половые хромосомы. В процессе раннего эмбрионального развития метилирование одной из двух Х-хромосом в соматических клетках приводит к её инактивации, позволяя таким образом компенсировать «избыточность» генов (однако в половых клетках метилирование «снимается», и все ооциты содержат обе активные хромосомы). 3
Учёные изучают эпигенетические модификации у разных существ. Самыми удобными для изучения являются организмы с большим разнообразием приспособительных стратегий, но при этом с относительно быстрым эмбриональным и постэмбриональным развитием.
Дополнительное преимущество – удобство получения образцов и работы с этими организмами. Именно поэтому в эпигенетических исследованиях распространённым модельным объектом являются рыбы. У костистых рыб эпигенетические модификации, которые происходят на ранних этапах развития, могут передаваться по наследству и влиять на процессы роста и выживаемости потомков. 4 Например, у мойвы (Mallotus villosus) изменения в тактике жизненного цикла – семелпарность и итеропарность – также связаны с метилированием генома, которое регулируется в зависимости от условий нереста.
Мойва, ведущая донный образ жизни (демерсальный нерест), размножается всего один раз. Данная стратегия размножения называется семельной – организм быстро стареет и умирает после того, как дал потомство. Это связано с относительно предсказуемыми условиями среды – на глубинах 10 до 300 м температура воды низкая и стабильная. Значит, потомство имеет больше шансов на выживание. Если рыба нерестится вблизи побережья, где температура воды выше, но меняется чаще, а также существует вероятность высыхания водоёма, выживание потомства становится крайне непредсказуемым. Рыбы, выбравшие тактику пляжного нереста, факультативно итеропарны – они могут размножаться больше одного раза за жизненный цикл. Однако до сих пор неизвестно, является ли выбор тактики размножения результатом генетических различий или эпигенетических изменений. Именно этот вопрос решили изучить исследователи из института Лаваля. 4
Используя данные полногеномного секвенирования донных и нерестящихся на пляже мойв из двух древних линий, обитающих в северо-восточной и северо-западной частях Атлантического океана и эволюционно разошедшихся около 2.5 млн лет назад, учёные проанализировали степень генетического расхождения между особями с разными тактиками размножения как внутри, так и между линиями. Затем с помощью метода бисульфитного секвенирования они количественно оценили влияние жизненного цикла и условий среды обитания на метилирование всего генома.
ДНК выделяли из клеток спинного плавника рыб методом солевой экстракции. Чтобы очистить ДНК от РНК, использовали РНКазу А, которая может расщеплять как одно- так и двуцепочечные РНК в зависимости от концентрации NaCl. Поскольку часть образцов была получена из готовых коллекций, неотъемлемым этапом работы стала проверка качества и количества ДНК в полученных образцах. Это удалось сделать с помощью гель-электрофореза и спектрофотометрии.
ДНК хорошего качества секвенировали с низким охватом (количество уникальных считываний каждого нуклеотида) – ~1.5 на особь. Если качество ДНК было низким, охват мог достигать 17 прочтений и выше. Для подготовки библиотек использовали только фрагменты ДНК с высоким молекулярным весом (>1 kb). Этот процесс включал фрагментацию и репарацию концов ДНК, лигирование адаптеров и двухэтапную ПЦР для того, чтобы добавить адаптеры секвенирования и баркоды и амплифицировать библиотеки. Полученные риды выравнивали по эталонному геному Mallotus villosus. Затем ДНК с присоединённым адаптером подвергали бисульфитной конверсии с последующей ПЦР-амплификацией и секвенированием для изучения паттерна метилирования. Обработка ДНК бисульфитом натрия вызывает дезаминирование неметилированных цитозиновых оснований с образованием урацила – после ПЦР они выявляются как тимины, в то время как метилированные цитозиновые основания остаются неизменными, указывая на метилирование (рис. 2). 4
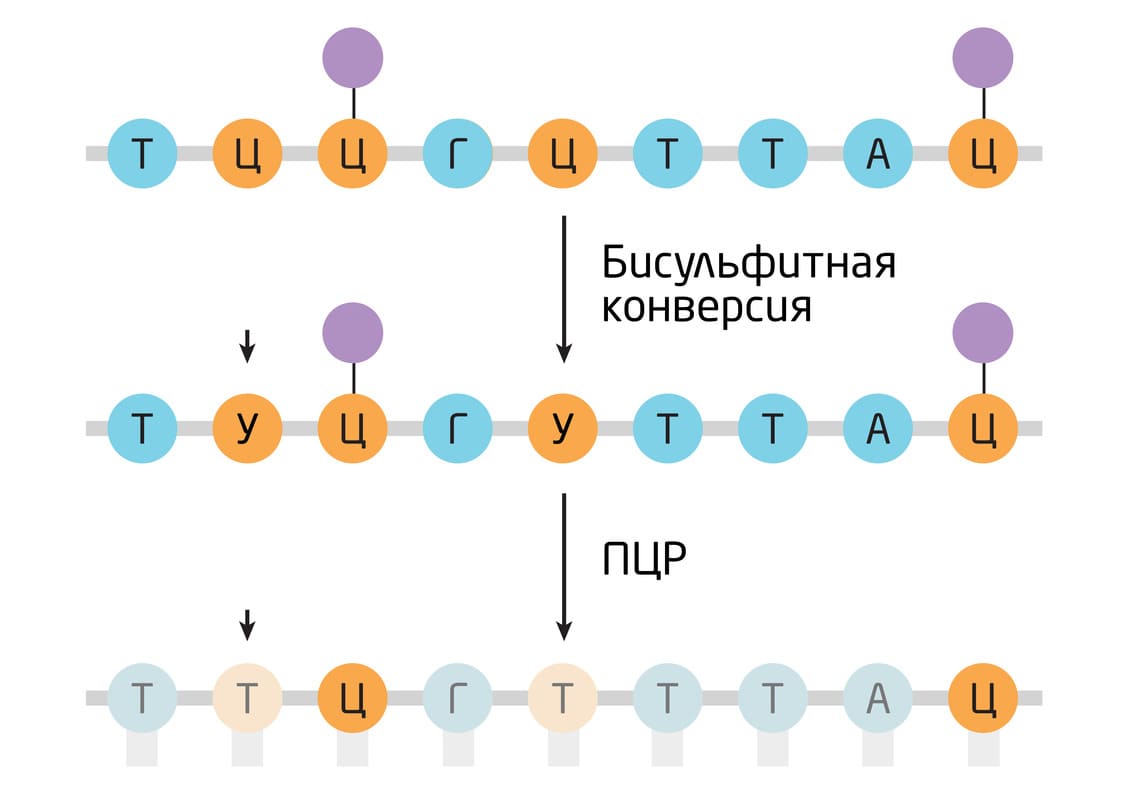 Рис. 2.Схема эксперимента. Изначальную последовательность ДНК подвергали бисульфитной конверсии, в результате чего на месте цитозиновых оснований образовывались урациловые, выявляющиеся на последующей ПЦР как тиминовые. Метилированные цитозиновые основания оставались неизменными.
Рис. 2.Схема эксперимента. Изначальную последовательность ДНК подвергали бисульфитной конверсии, в результате чего на месте цитозиновых оснований образовывались урациловые, выявляющиеся на последующей ПЦР как тиминовые. Метилированные цитозиновые основания оставались неизменными.
Результаты исследования показали, что изменения в жизненном цикле действительно были связаны с эпигенетическими изменениями в обеих линиях рыб, несмотря на высокий поток генов между донными и нерестящимися на пляже особями. Вместе с этим, как и ожидалось, были обнаружены выраженные генетические различия между двумя линиями, в то время как внутривидовые различия оказались относительно небольшими, несмотря на разные стратегии размножения. Эпигенетическая изменчивость в большей степени была связана с уровнем генетической изменчивости у рыб, обитающих в северо-восточной части Атлантического океана. При этом учёные подчёркивают, что эпигенетические модификации во многом определялись генетическим потенциалом: различия в метилировании становились менее значимыми после учёта генетической изменчивости (рис. 3). 4
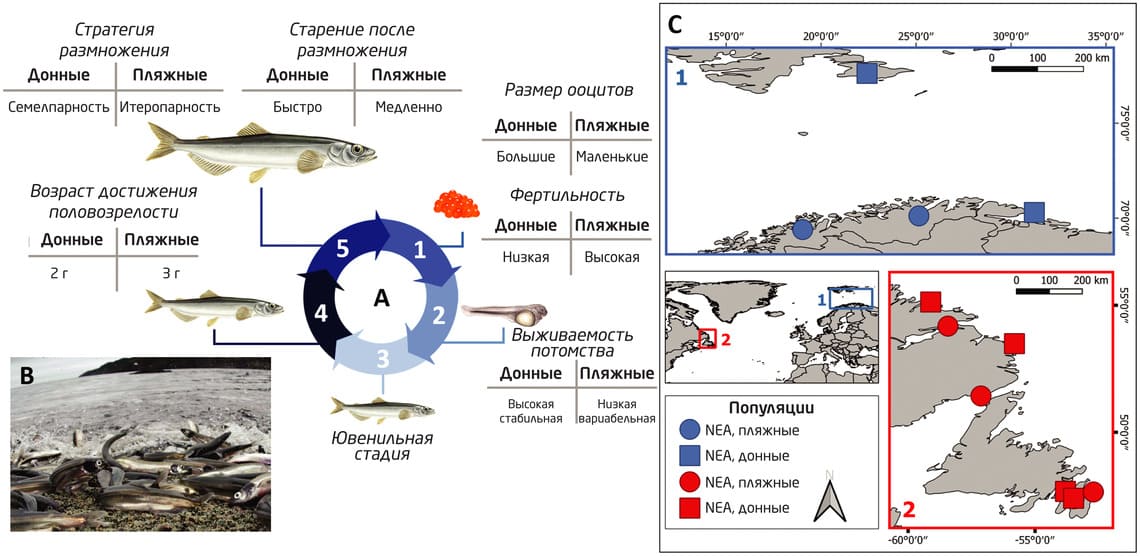 Рис. 3.Две тактики размножения (A, B) и области обитания (C) двух линий мойвы (Mallotus villosus). (A) Различия в жизненном цикле особей, нерестящихся на дне и на пляже. (1) Стадия ооцита: донные нерестящиеся особи размножаются на нерестилищах, расположенных на глубине от 10 до 250 м, где температура воды низкая, а условия окружающей среды относительно стабильные и предсказуемые. (B) Особи, обитающие в прибрежных областях, нерестятся в приливной зоне, где условия окружающей среды нестабильны (например, переменная, но обычно более высокая температура воды, ветер и высокая вероятность высыхания водоема). Самки, нерестящиеся на дне, производят меньше яиц, чем самки, нерестящиеся в приливной зоне; их яйца более крупные и развиваются медленнее. (2–3) У пляжных видов яйца меньше, но скорость развития эмбрионов значительно выше из-за более высокой температуры воды в прибрежных нерестилищах. (4) Половозрелая стадия: половая зрелость обычно достигается в 2 или 3 года. (5) Взрослая особь: достигшие половой зрелости самцы и самки, нерестящиеся в придонных нерестилищах, размножаются один раз за жизненный цикл (семелпарность). После этого особи быстро стареют и умирают. Особи, нерестящиеся в прибрежных областях, особенно самки, могут размножаться в течение двух лет подряд (факультативная итеропарность); процессы старения протекают медленнее. У самок, нерестящихся на пляже, плодовитость не снижается во время второго репродуктивного периода, что свидетельствует о незначительном репродуктивном старении.
4
Рис. 3.Две тактики размножения (A, B) и области обитания (C) двух линий мойвы (Mallotus villosus). (A) Различия в жизненном цикле особей, нерестящихся на дне и на пляже. (1) Стадия ооцита: донные нерестящиеся особи размножаются на нерестилищах, расположенных на глубине от 10 до 250 м, где температура воды низкая, а условия окружающей среды относительно стабильные и предсказуемые. (B) Особи, обитающие в прибрежных областях, нерестятся в приливной зоне, где условия окружающей среды нестабильны (например, переменная, но обычно более высокая температура воды, ветер и высокая вероятность высыхания водоема). Самки, нерестящиеся на дне, производят меньше яиц, чем самки, нерестящиеся в приливной зоне; их яйца более крупные и развиваются медленнее. (2–3) У пляжных видов яйца меньше, но скорость развития эмбрионов значительно выше из-за более высокой температуры воды в прибрежных нерестилищах. (4) Половозрелая стадия: половая зрелость обычно достигается в 2 или 3 года. (5) Взрослая особь: достигшие половой зрелости самцы и самки, нерестящиеся в придонных нерестилищах, размножаются один раз за жизненный цикл (семелпарность). После этого особи быстро стареют и умирают. Особи, нерестящиеся в прибрежных областях, особенно самки, могут размножаться в течение двух лет подряд (факультативная итеропарность); процессы старения протекают медленнее. У самок, нерестящихся на пляже, плодовитость не снижается во время второго репродуктивного периода, что свидетельствует о незначительном репродуктивном старении.
4
У морских костистых рыб Mallotus villosus эпигенетические модификации, вероятно, были вызваны изменениями в температуре и солёности воды во время эмбрионального развития – именно на этой стадии условия окружающей среды сильнее всего влияют на паттерны метилирования ДНК как у пресноводных, так и у морских рыб. Не исключено, что и другие биотические факторы могли вызывать стабильные эпигенетические изменения, которые накапливались в течение раннего развития, сохранялись у взрослых особей, а затем передавались будущим поколениям. У взрослых рыб вероятность таких эпигеномных модификаций гораздо ниже, поскольку обычно они проводят в местах нереста не более 24 часов. 4
Полученные данные ещё раз подтверждают важнейшую роль эпигенетических модификаций в фенотипической диверсификации и адаптации животных к изменениям окружающей среды. В данном случае – к разным условиям нереста. Эпигенетическая изменчивость приводит ко внутривидовым изменениям в тактике жизненного цикла животных, позволяя им обитать в новой и непредсказуемой среде. При этом степень эпигенетических различий остаётся под контролем генома. Об этом свидетельствуют различия в степени метилирования генома между двумя линиями рыб, обитающих в разных географических зонах, и более высокая степень зависимости метилирования от генетической изменчивости у особей, обитающих в северо-восточной части Атлантического океана.
Литература
1. Yong W. et al. Profiling genome-wide DNA methylation. Epigenetics & Chromatin, 2016.
2. Sachiko T. et al. Genome methylation in D. melanogaster is found at specific short motifs and is independent of DNMT2 activity. Genome research, 2014.
3. Yukio Y. et al. X chromosome-wide analyses of genomic DNA methylation states and gene expression in male and female neutrophils. Proceedings of the National Academy of Sciences of the United States of America, 2010.
4. Venney C.J. et al. Genome-wide DNA methylation predicts environmentally driven life history variation in a marine fish. Evolution, 2023.




.jpg)
























