Медиатека
Биоортогональная химия. Часть 2: Применение методов в науках о жизни
Биоортогональная химия (БОХ) богата реакциями и предлагает широкую палитру инструментов для разных приложений. Визуализация живых клеток и отдельных молекул произвели революцию в биологии благодаря биоортогональным реакциям, которые позволили отслеживать химические репортёры после их метаболического включения в биомолекулы-мишени. Профилирование белков на основе активности (ABPP, activity-based protein profiling) использует достижения в области дизайна реакций и зондов для понимания функции белков в сложных биологических системах.
Применение БОХ в науке о полимерах и материалах значительно расширилось, включая изготовление трёхмерных сетей, гидрогелей для живых клеток и новые стратегии доставки лекарств. Новое поколение химических реакций используется не только для образования связи, но и для «разрыва» связи с целью высвобождения или активации биомолекул. В совокупности инструменты БОХ предоставляют широкий набор методов, которые влияют на междисциплинарные отрасли и активно внедряются в медицинские исследования. 1
В данной статье мы подробно расскажем об основных направлениях исследований, в которых применяется БОХ, однако для начала рекомендуем вам ознакомиться с другой нашей статьёй, посвящённой основным принципам, реакциям и методам БОХ.
Визуализация биомолекул
1. Белки
Методы биортогонального (BONCAT) и флуоресцентного (FUNCAT) мечения неканонических аминокислот (Bioorthogonal/ Fluorescent Noncanonical Amino acid Tagging) предназначены для идентификации и (или) визуализации вновь синтезированных белков (Рис. 1). С помощью BONCAT в белки включают аффинные метки для идентификации и последующей экстракции и очистки белка, в то время как FUNCAT используют флуоресцентные метки для визуализации синтезированных белков. BONCAT и FUNCAT применяют в рамках протеомных исследований на разных микробных, растительных и животных моделях. 2, 3
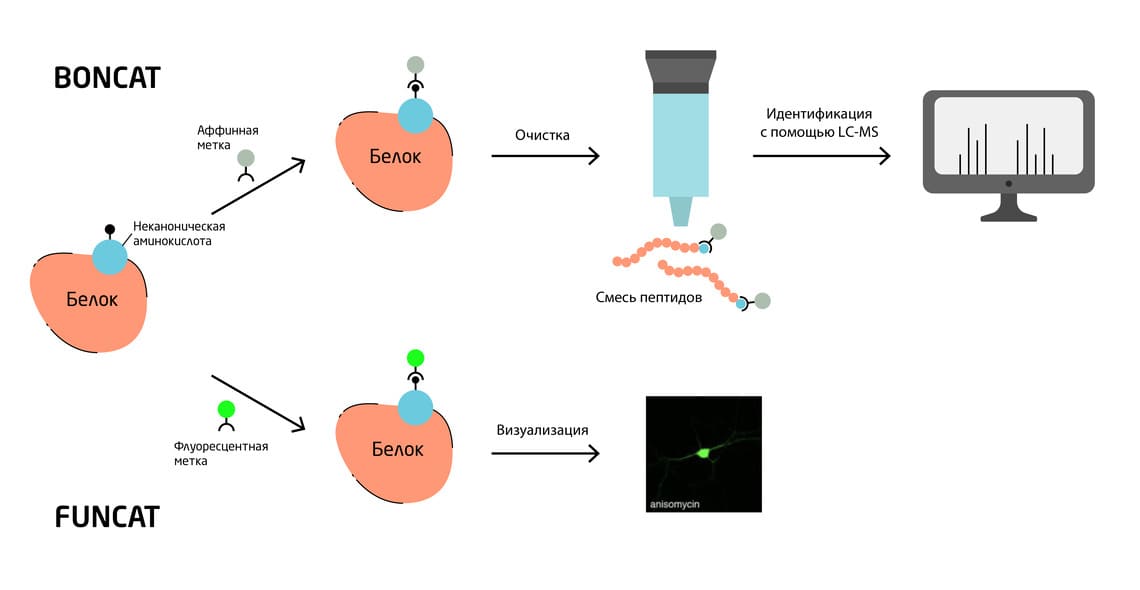
Рис. 1. Методы биоортогонального (BONCAT) и флуоресцентного (FUNCAT) мечения неканонических аминокислот.
Например, в работе Оливье Дионна и Франсуа Корбина 4 использовался азидогомоаланин (AГA) для обнаружения белковых биомаркеров в новосинтезированном протеоме мононуклеарных клеток периферической крови при синдроме Мартина-Белла (ломкой X-хромосомы). Клетки были выделены из крови больных и здоровых людей из контрольной группы. Затем их инкубировали для истощения запасов метионина и добавляли AГA. Клеточные белки экстрагировали и конъюгировали с ортогональным биотиновым зондом. После этого биотинилированные белки выделяли и анализировали с использованием методов жидкостной хроматографии-масс-спектрометрии. Такой анализ позволил идентифицировать несколько белков, экспрессия которых была либо повышена, либо снижена в клетках пациентов с ломкой X-хромосомой. Одиннадцать из этих белков стали потенциальными биомаркерами.
Метод FUNCAT использовали для отслеживания динамики протеома мезенхимальных стволовых клеток (МСК) в исследовании процесса локальной регенерации конечностей после ишемии. Мышам, экспрессирующим мутантную метионил-тРНК-синтетазу, после ишемии задних конечностей или контрольной ложной операции вводили азидонорлейцин. Затем ишемизированные ткани собирали для гистологического анализа и обрабатывали для обогащения белком на основе «клик»-реакции с последующим масс-спектрометрическим и биоинформатическим анализом. Белки с азидной меткой в срезах ткани подвергали реакции click-iT с алкин-Alexa Fluor 488. МСК продемонстрировали сильный зелёный флуоресцентный сигнал в культуре клеток, а также в ткани мышц после ишемии, что указывает на эффективный синтез новых белков. 5
В другом исследовании учёные одновременно пометили геном и капсид вируса оспавакцины (Vaccinia virus) (Рис. 2). Меченный азидом L-азидогомоаланин был добавлен в среду для культивирования клеток Vero и включался в вирусный капсид. В результате биоортогональной реакции азид-алкинового циклоприсоединения к меченым капсидным белкам был добавлен флуоресцентный краситель Fluor 525. В то же время нуклеиновые кислоты с включённым биоортогональным предшественником 5-винил-2'-дезоксиуридином были помечены тетразином Cy5. Такое одновременное мечение двумя флуоресцентными красителями позволило отследить динамическое поведения вируса. 6
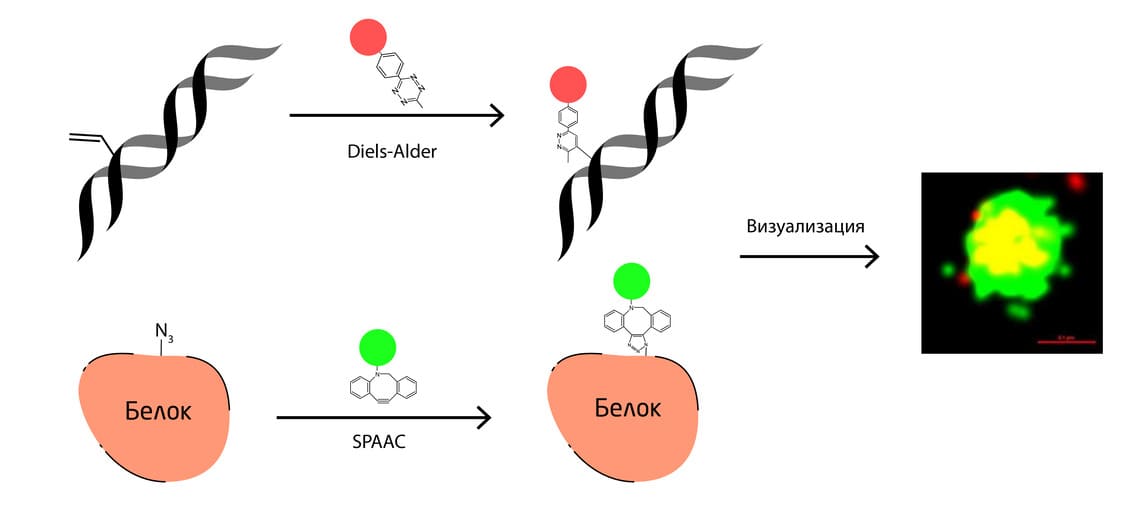
Рис. 2. Одновременное мечение генома и вирусного капсида флуоресцентными красителями с использованием методов БОХ.
2. Нуклеиновые кислоты
Учёные разработали способ маркировать ДНК и РНК помощью тройной реакции в один «клик». Этот подход объединил разные биоортогональные группы. Сначала в ходе твёрдофазного синтеза вводили норборненовый и алкиновый фрагменты. Затем ферментативно добавляли азидо-модифицированный нуклеотид с использованием терминальной дезоксинуклеотидилтрансферазы (TdT) или поли(А)-полимеразы (PAP). Для мечения всех трёх реактивных «ручек» тремя разными флуорофорами была проведена однократная «клик»-реакция (Рис. 3). Такую тройную маркировку можно использовать для изучения динамики структуры нуклеиновых кислот во время фолдинга и совокупности множественных способов укладки с использованием метода FRET. 7
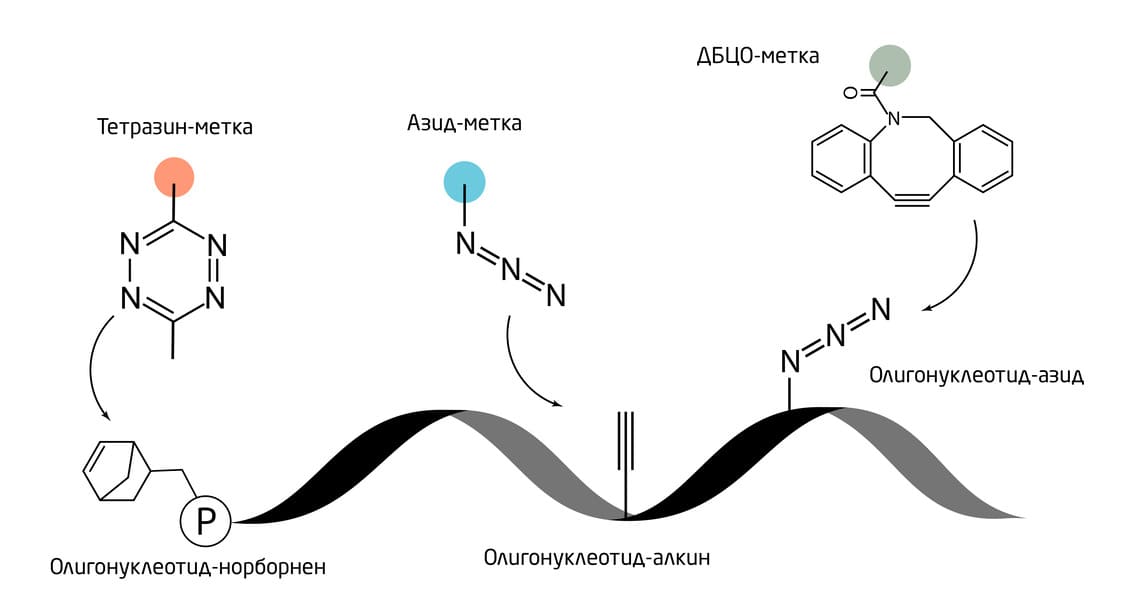
Рис. 3. Тройная маркировка нуклеиновых кислот методами БОХ.
Ещё одна группа учёных разработала стратегию биоортогонального мечения новосинтезированной РНК в единичных клетках. К клеткам млекопитающих добавляли 6-N-аллиладенозин, который метаболически встраивался в РНК по мере синтеза. Затем вновь синтезированные РНК помечали модифицированными тетразином праймерами. Эти праймеры могут инициировать амплификацию по принципу «катящегося кольца», создавая тандемные длинные одиночные нити ДНК для захвата сотен флуоресцентных зондов, тем самым усиливая сигнал (Рис. 4). Используя этот метод, учёные исследовали субклеточное распределение вновь синтезированных РНК и обнаружили специфичность такого распределения в зависимости от типа клеток и его гетерогенность распределения от клетки к клетке. 8
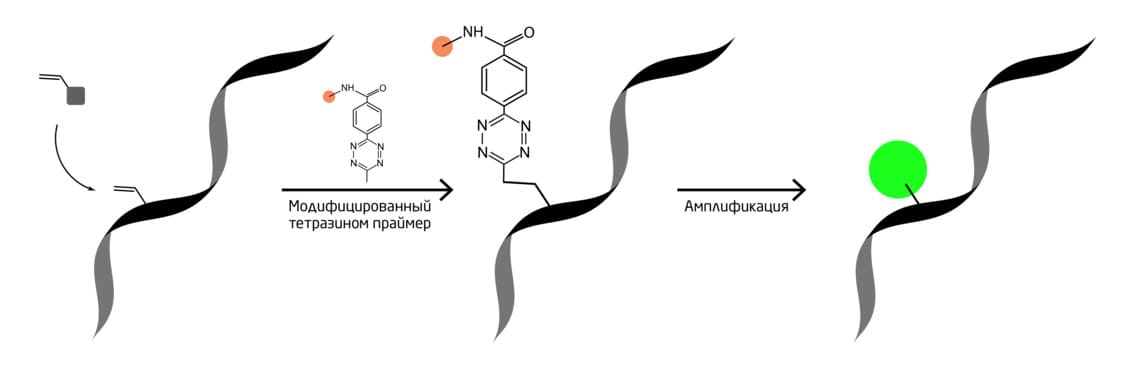
Рис. 4. Мечение новосинтезированной РНК в единичных клетках методами БОХ.
3. Гликаны
Методы биоортогональной химии поспособствовали более глубокому пониманию структуры, локализации и биологических функций гликанов – олигосахаридов, присоединённых к пептидам, белкам и липидам. Один из таких методов – метод селективного мечения лизосом с использованием метаболического включения меченой азидом сиаловой кислоты в клетках человека (Рис. 5). Красители присоединяли к дибензоциклооктину (ДБЦО) с помощью аминосодержащего линкера. Лизосомы имеют значительно более низкие значения рН (рН 4,0-4,5), чем цитоплазма, поэтому присутствующая кислота протонировала аминовый линкер ДБЦО, образуя положительно заряженный ион аммония, который не мог пройти через лизосомальную мембрану. Таким образом, ДБЦО мог реагировать только с азидами на внутренней стороне лизосомальной мембраны.
Два разных красителя были конъюгированы с фрагментом ДБЦО. Нечувствительный к кислоте синий кумариновый краситель использовался для маркировки лизосом, а красный родаминовый краситель, чувствительный к кислоте, – для разделения функциональных лизосом (в которых он флуоресцирует) и деполяризованных лизосом (в которых он не флуоресцирует). Лизосомы маркировали путём включения меченной азидом сиаловой кислоты и обработки клеток красителями, связанными с ДБЦО. Внешняя мембрана лизосом помечалась непроницаемым для клеток флуоресцеином, чтобы показать дополнительные детали.
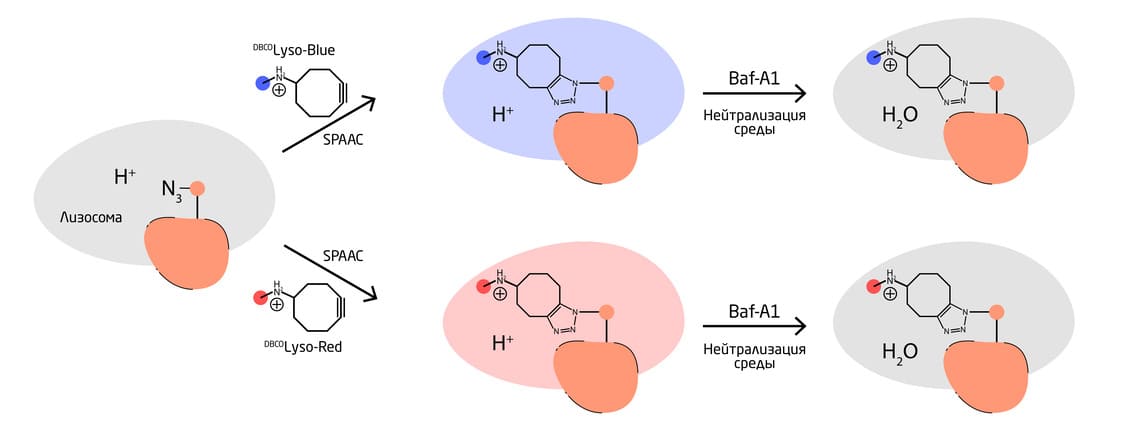
Рис. 5. Селективное мечение лизосом в клетках человека методами БОХ.
С помощью разработанного подхода учёные изучили процесс экзоцитоза (красная флуоресценция уменьшалась по мере развития экзоцитоза, и лизосомы становились менее кислыми), а также проницаемость лизосомальных мембран (ПЛМ). Меченный флуоресцеином декстран использовали для отслеживания увеличения ПЛМ при клеточном стрессе. При этом потеря флуоресцеиновой метки из лизосом коррелировала с увеличением проницаемости мембран. При использовании меченых клеток отношение синей флуоресценции (от нечувствительной к кислоте маркировки) к флуоресценции флуоресцеина позволило авторам отслеживать ПЛМ. Затем ПЛМ использовали для сравнения изменений лизосомальной функции, вызванных различными формами клеточной гибели (апоптоз, ферроптоз, пироптоз и некроз). Было обнаружено, что ПЛМ сильнее изменяется при некрозе, чем при ферроптозе, и меньше – при апоптозе и пироптозе. Таким образом, комбинация мечения метаболических гликанов и биоортогональной химии позволила лучше понять влияние функции и целостности лизосом на клеточную судьбу и процессы при различных формах клеточной гибели. 9
4. Липиды
Для визуализации аппарата Гольджи в клетках HeLa учёные применили реакцию взаимодействия транс-циклооктен-содержащего церамидного липида и высокореактивного красителя ближнего инфракрасного (ИК) диапазона с тетразином (Рис. 6). Культуры клеток обрабатывали церамидом с биоортогональной меткой для метаболического включения в мембрану аппарата Гольджи, после чего добавляли меченый тетразином ИК-краситель. В результате быстрой и эффективной реакции аппарат Гольджи был маркирован, что позволило пролонгировать визуализацию живых клеток с помощью 3D конфокальной и STED-микроскопии (микроскопии сверхвысокого разрешения). 10
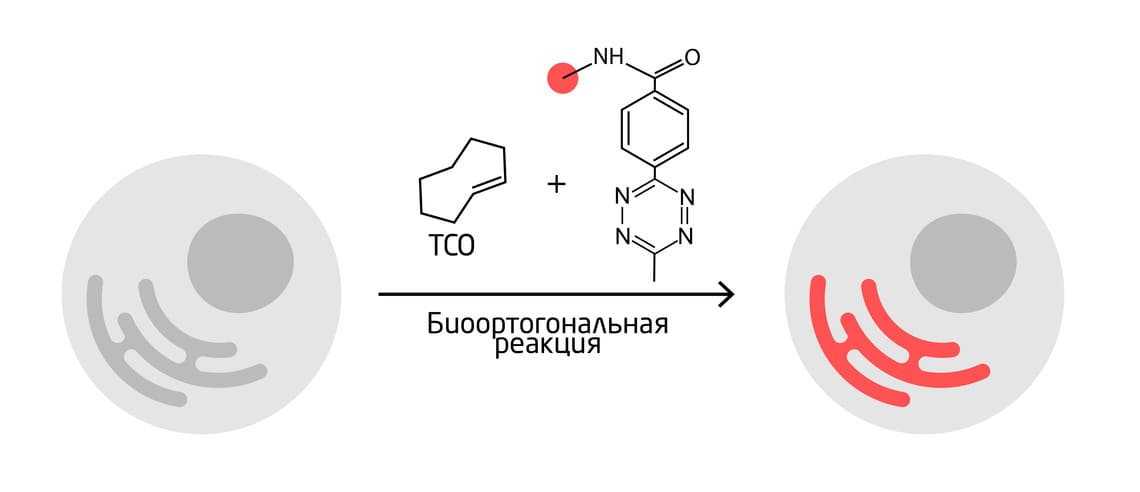
Рис. 6. Визуализация аппарата Гольджи методами БОХ.
Исследователи представили новый надежный и универсальный метод маркировки стеринов в клетках. К клеткам добавляли функциональные аналоги холестерина и оксистерола –19-этинилхолестерин и 25-гидрокси-19-этинилхолестерин. Молекулы эффективно интегрировались в клеточные мембраны посредством метаболического включения, а последующее мечение клеток азидо-производным флуоресцеина позволило визуализировать и исследовать их с помощью микроскопии высокого разрешения. Данный метод можно использовать для анализа функции стеролов в клетках в норме и при патологиях. 11
Методы биоортогональной химии в доставке лекарств
Таргетная доставка лекарственных и других активных веществ важна для того, чтобы они корректно выполняли свою функцию в живых организмах. Улучшенный контроль над доставкой, высвобождением и активацией лекарств in vivo – один из способов повышения их эффективности и сведения к минимуму побочных эффектов. На помощь в этом направлении также приходят методы БОХ.
Один из способов заключается в избирательном высвобождении лекарств методом «click-to-release» (CTR) 12. Для реакции необходимо присутствие двух компонентов: один из них направленно локализуется вблизи целевого местоположения; второй – лекарство с химической меткой – высвобождается в результате биоортогональной реакции только там, где находится первый компонент (Рис. 7). Метод показал высокую эффективность и избирательность в лечении онкологических заболеваний: противоопухолевый препарат проникал в раковые клетки, где он мог их убить, в то время как другие клетки оставались незатронутыми, т.к. они не подвергались воздействию свободного препарата. Некоторые вариации 13 этого метода уже проходят клинические испытания и демонстрируют высокие показатели эффективности.
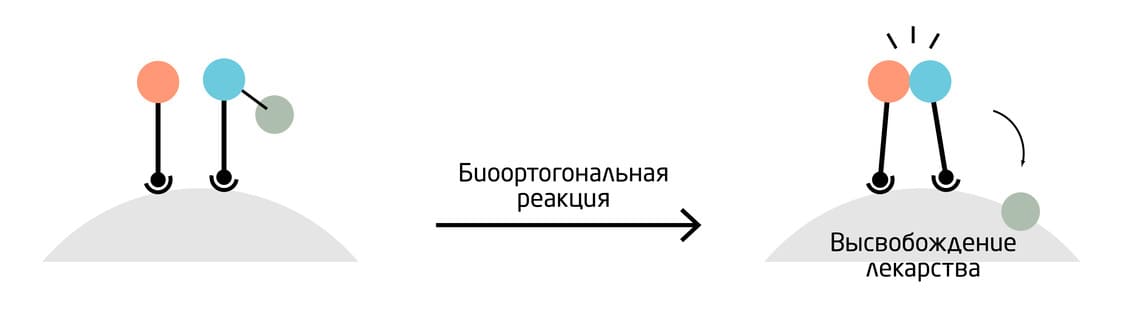
Рис. 7. Доставка лекарств in vivo методом избирательного высвобождения лекарств.
Другой подход основан на использовании липидных наночастиц (ЛНЧ). Твёрдые опухоли избирательно удерживают ЛНЧ, потому что при ангиогенезе в опухолях формируются негерметичные кровеносные сосуды, которые позволяют наночастицам проникать в опухоли легче, чем нормальные ткани, и удерживаться в них. Таким образом, ЛНЧ, содержащие меченые азидом предшественники, можно доставить в опухоли избирательно. Включение в ЛНЧ лигандов, специфичных для раковых клеток, позволит улучшить их селективность в отношении раковых клеток. 14
Биоортогональная химия – яркий пример междисциплинарного подхода, «плоды» которого оказались востребованы в самых разных направлениях исследований. Универсальность, простота и доступность методов БОХ способствовали их широкому распространению. В будущем может быть разработано ещё больше возможностей для познания природы и улучшения качества жизни.
Литература
1. Bird R.E., Lemmel S.A., Yu X., Zhou Q.A. Bioorthogonal Chemistry and Its Applications. Bioconjugate Chemistry, 2021.
2. Tom Dieck S. et al. Metabolic labeling with noncanonical amino acids and visualization by chemoselective fluorescent tagging. Current Protocols in Cell Biology, 2012.
3. Dieterich D.C. et al. Selective identification of newly synthesized proteins in mammalian cells using bioorthogonal noncanonical amino acid tagging (BONCAT). Proceedings of the National Academy of Sciences of the United States of America, 2006.
4. Dionne O., Corbin F. A new strategy to uncover fragile X proteomic biomarkers using the nascent proteome of peripheral blood mononuclear cells (PBMCs). Scientific Reports, 2021.
5. Du Y. et al. Deciphering the in vivo Dynamic Proteomics of Mesenchymal Stem Cells in Critical Limb Ischemia. Frontiers in Cell and Developmental Biology, 2021.
6. Huang L.L. et al. Integrating Two Efficient and Specific Bioorthogonal Ligation Reactions with Natural Metabolic Incorporation in One Cell for Virus Dual Labeling. Analytical Chemistry, 2017.
7. Winz M.L., Linder E.C., Becker J., Jäschke A. Site-specific one-pot triple click labeling for DNA and RNA. Chemical Communications Journal, 2018.
8. Bai M. et al. Visualizing Newly Synthesized RNA by Bioorthogonal Labeling-Primed DNA Amplification. Analytical Chemistry, 2020.
9. Zhang E., Shi Y., Han J., Han S. Organelle-Directed Metabolic Glycan Labeling and Optical Tracking of Dysfunctional Lysosomes Thereof. Analytical Chemistry, 2020.
10. Erdmann R.S., Toomre D., Schepartz A. STED Imaging of Golgi Dynamics with Cer-SiR: A Two-Component, Photostable, High-Density Lipid Probe for Live Cells. Methods in Molecular Biology, 2017.
11. Jao С.Y. et al. Bioorthogonal probes for imaging sterols in cells. Chembiochem, 2015.
12. Ji X. Click and release: bioorthogonal approaches to "on-demand" activation of prodrugs. Chemical Society Reviews, 2019.
13. Phase 1/2a Study of SQ3370 in Patients With Advanced Solid Tumors. US National Library Of Medicine clinical trials, 2021.
14. Kalyane D. et al. Employment of enhanced permeability and retention effect (EPR): Nanoparticle-based precision tools for targeting of therapeutic and diagnostic agent in cancer. Materials Science and Engineering: C, Materials for biological applications, 2019.




.jpg)
























