Медиатека
ПЦР: новые решения и будущее известного метода
Оглавление:
• Количественная ПЦР, или ПЦР в реальном времени
• Цифровая ПЦР
• Некоторые другие ПЦР-подходы
• Будущее метода ПЦР
Не так давно мы уже познакомили наших читателей с основами классической полимеразной цепной реакции (ПЦР). С момента возникновения этой технологии прошло почти 40 лет. Всё это время наука и медицина не стояли на месте, а вместе с ними менялся и метод ПЦР (Рис. 1). В современных лабораториях вы можете встретить множество модификаций этого подхода, адаптированных для решения конкретных задач. О некоторых современных решениях и пойдет речь в этой статье.
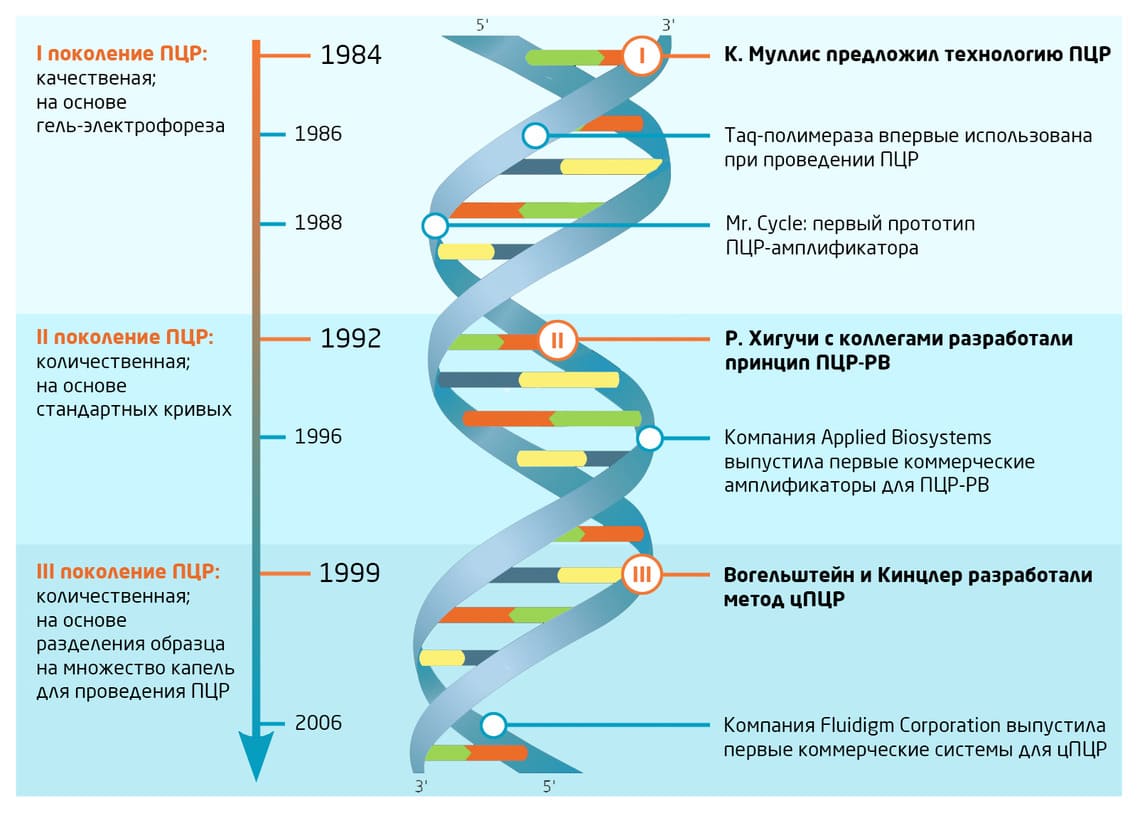 Рис. 1. Ключевые этапы развития ПЦР-технологии.
Рис. 1. Ключевые этапы развития ПЦР-технологии.
Источник >>
Опуская подробности, с которыми вы можете ознакомиться в первой части нашего обзора про ПЦР, напомним, что ПЦР — это технология, позволяющая амплифицировать, то есть многократно умножать количество определенного ДНК-фрагмента. Фрагмент, который нужно амплифицировать, задаётся с помощью праймеров — коротких нуклеотидных последовательностей, которые инициируют синтез ДНК и тем самым ограничивают нужный фрагмент. В классическом случае для проведения ПЦР смесь, содержащую ДНК с амплифицируемым фрагментом, праймеры и другие необходимые компоненты помещают в особый прибор — амплификатор. В нём обеспечивается поддержание температурных условий, оптимальных для синтеза искомого участка ДНК. С каждым циклом число этих участков удваивается. Полученные в результате реакции продукты разделяют с помощью гель-электрофореза и визуализируют, чтобы определить наличие или отсутствие искомого участка.
Количественная ПЦР, или ПЦР в реальном времени
Классический метод ПЦР хорошо подходит, когда необходимо получить однозначный ответ на вопрос — встречается ли данная ДНК-последовательность в образце? Например, когда проводят ПЦР-тест на коронавирус, то наличие коронавирус-специфичного генетического материала в пробе пациента будет надежным подтверждением диагноза. Такой метод ПЦР называется качественным, потому что он говорит «да» или «нет», но ничего — о количестве вещества в исходном образце.
Между тем, для многих задач, например, для оценки эффективности заражения клеток вирусным вектором или выявления соотношения разных типов бактерий в микробиоте, необходимо иметь представление о количестве молекул с заданной последовательностью в исходном образце. Определить его помогает особая разновидность ПЦР — количественная ПЦР, или ПЦР в реальном времени (ПЦР-РВ). Этот метод основан на автоматическом детектировании ДНК по завершении каждого цикла прямо в процессе амплификации либо с помощью флуоресцентных красителей, неспецифично встраивающихся между двумя нитями ДНК, либо посредством связывания с флуоресцентно-меченными олигонуклеотидами (Рис. 2). ПЦР-РВ была разработана группой американских исследователей во главе с Расселом Хигучи в 1992 году 1. Они добавили к ПЦР-смеси бромистый этидий — флуоресцентный краситель, который встраивается в двуцепочечную ДНК и испускает свечение под действием ультрафиолета. В результате накопление ДНК сопровождалось усилением свечения, которое росло с каждым циклом и позволяло произвести количественную оценку генетического материала в исходной смеси 2.
На сегодняшний день наиболее широко используемый неспецифический краситель — SYBR Green I (Рис. 2, слева). Его эффективность связывания с двуцепочечной ДНК в 100 раз выше, чем у бромистого этидия. При встраивании в ДНК интенсивность флуоресценции SYBR Green I увеличивается более чем в 1000 раз 3, поэтому этот краситель отлично подходит для детектирования встроенными фотодатчиками современных ПЦР-систем.
 Рис. 2. Принцип работы флуоресцентных красителей на примере SYBR Green I (слева) и флуоресцентно-меченных олигонуклеотидов на примере TaqMan (справа).
Рис. 2. Принцип работы флуоресцентных красителей на примере SYBR Green I (слева) и флуоресцентно-меченных олигонуклеотидов на примере TaqMan (справа).
Источник >>
Оценка количества молекул исходного образца методом ПЦР-РВ производится на основе графика амплификации (Рис. 3), который отражает изменение интенсивности флуоресценции от числа циклов. По графику рассчитывают коэффициент Ct — он показывает сколько ПЦР-циклов необходимо, чтобы флуоресцентный сигнал превысил пороговый уровень шума. Чем меньше Ct, тем больше генетического материала с амплифицируемым фрагментом было в исходной пробе. Для расчета количества молекул мишени в исходной пробе используют калибровочную кривую — кривую амплификации для образца с уже известным количеством вещества. Число молекул целевой ДНК в первоначальном образце оценивают относительно этого стандартного образца, поэтому такая оценка является относительной 4.
 Рис. 3. Схематичное изображение стандартных кривых, используемых для оценки исходного количества исследуемого генетического материала в ПЦР-РВ. Каждая кривая отражает амплификацию ДНК-фрагментов одного типа. Кривая с наименьшим Ct соответствует наибольшему числу молекул в исходном образце (10000 молекул). Ct — пороговое число циклов; может быть дробным.
Рис. 3. Схематичное изображение стандартных кривых, используемых для оценки исходного количества исследуемого генетического материала в ПЦР-РВ. Каждая кривая отражает амплификацию ДНК-фрагментов одного типа. Кривая с наименьшим Ct соответствует наибольшему числу молекул в исходном образце (10000 молекул). Ct — пороговое число циклов; может быть дробным.
Источник >>
ПЦР-РВ не требует извлечения продуктов реакции для их визуализации, как это происходит в классической ПЦР, поэтому этот подход позволяет получить более точный и надёжный результат. А благодаря постоянному совершенствованию технического и программного обеспечения, относительно низкой себестоимости и появлению все новых модификаций ПЦР, которые можно комбинировать с ПЦР-РВ, этот подход приобрел исключительную популярность для обнаружения патогенов, анализа состава продуктов питания, оценки соотношения биологических компонентов в смеси и многих других задач 2, 5.
Цифровая ПЦР
Детектировать и оценить количество искомого образца методом ПЦР-РВ можно только если число копий в пробе не менее ~10-100 6, 7. Однако эффективная характеристика генетических и эпигенетических изменений в онкологии, вирусологии или пренатальной диагностике требует еще более точных решений, ведь цена промедления или ошибки — человеческая жизнь.
Развитие микрофлюидных технологий и устройств «лаборатория-на-чипе» способствовало созданию цифровой ПЦР (цПЦР) 8, 9 — усовершенствованной ПЦР-технологии, которая отлично подходит для исследований, требующих исключительно высокой чувствительности и надежности. На сегодняшний день метод цПЦР — наиболее высокоточная разновидность ПЦР (Рис. 1). Он позволяет обнаружить даже одну молекулу нуклеиновой кислоты в пробе!
Благодаря своей исключительной чувствительности и специфичности в сочетании с возможностью проводить количественный анализ для разных типов биологических образцов цПЦР — это уникальный подход для исследования рака. Опухолевые клетки отличаются от здоровых множеством аномалий в генетическом материале и метаболизме, которые могут служить надежными маркерами для диагностики и оценки эффективности выбранной терапии. цПЦР — незаменимое решение для детектирования редких мутаций (Рис. 4) и продуктов обмена клеток раковой опухоли благодаря способности выявлять даже самые редкие молекулы в клиническом образце 7, 8.
 Рис. 4. Благодаря усовершенствованному подходу, цПЦР — в отличие от классической ПЦР и ПЦР-РВ — позволяет обнаружить даже одну молекулу в образце.
8
Рис. 4. Благодаря усовершенствованному подходу, цПЦР — в отличие от классической ПЦР и ПЦР-РВ — позволяет обнаружить даже одну молекулу в образце.
8
Технология цПЦР используется и как высокоточное решение для диагностики новой коронавирусной инфекции COVID-19. В то время как средняя точность стандартного теста на COVID-19 методом ПЦР-РВ составляет 68-78% (при взятии мазка из полости носа/глотки 10), она резко снижается при низкой вирусной нагрузке, — например, до проявления симптомов коронавируса или уже на стадии выздоровления. Недостаток чувствительности сказывается на эпидемиологической обстановке, ведь рост числа ложноотрицательных тестов задерживает постановку диагноза и начало лечения или ведет к преждевременной выписке, подвергая риску контактирующих с пациентом людей. Именно поэтому тест-системы на основе цПЦР набирают все большую популярность 11, 12. Помимо COVID-19, цПЦР также показал более высокую в сравнении с другими подходами эффективность в диагностике особо опасных для человека вирусных инфекций, таких как вирусы гепатита В, иммунодефицита человека и папилломы человека 11, 13.
Принцип цПЦР основывается на разделении содержащего амплифицируемый фрагмент образца на тысячи или даже миллион отдельных фракций (например, капель), в каждой из которых в идеале оказывается одна или ни одной молекулы нуклеиновой кислоты. Затем в каждой из фракций одновременно проводят ПЦР
9. В результате метод цПЦР позволяет провести сразу тысячи микрореакций для одного образца. Другое важное отличие цПЦР от ПЦР-РВ заключается в том, что метод не требует построения стандартных кривых ПЦР (Рис. 3), а расчет количества молекул вещества в исходном образце производится из предположения о том, что в каждой фракции, изначально содержавшей молекулу искомого вещества, будет детектирован флуоресцентный сигнал, а во всех других — нет
14 (Рис. 5). Благодаря такому подходу метод цПЦР позволяет проводить абсолютную количественную оценку мишени и детектировать даже единичные молекулы в образце. А, поскольку эффективность реакции оказывает меньшее влияние на качество данных, цПЦР менее чувствительна к наличию ингибиторов реакции в образе
11.
Если после разделения образца на фракции в каждой их них оказывается либо одна, либо ни одной молекулы-мишени, оценить число молекул в исходной пробе можно просто посчитав число «положительных» фракций. Но что если в одной капле на самом деле находится больше одной молекулы? Скорректировать расчеты и получить достоверный результат помогают стандартные статистические подходы. Распределение молекул по фракциям цПЦР следует распределению Пуассона. Согласно этой модели, чем больше число «положительных» капель, тем больше вероятность, что в каждой капле содержится более одной молекулы-мишени. На основе числа «отрицательных» фракций модель Пуассона предсказывает вероятность нахождения в «положительных» фракциях одной и более копий. В результате использование модели Пуассона для аппроксимации числа целевых молекул в исходной пробе позволяет получить достоверный результат даже при не оптимальном разделении образца.
 Рис. 5. Этапы проведения эксперимента с использованием автоматической капельной цПЦР-системы от RainSure.
Рис. 5. Этапы проведения эксперимента с использованием автоматической капельной цПЦР-системы от RainSure.
Источник 1 >>;
Источник 2 >>;
Источник 3 >>;
Источник 4 >>;
Источник 5 >>
Некоторые другие ПЦР-подходы
ПЦР-РВ и цПЦР часто комбинируют с другими ПЦР-подходами. На сегодняшний день таких подходов, позволяющих решать конкретные исследовательские и медицинские задачи, огромное количество. Ниже мы расскажем о трех крайне перспективных решениях, которые широко применяются уже сейчас.
Один из часто используемых подходов — ПЦР с обратной транскрипцией (ОТ-ПЦР). ОТ-ПЦР позволяет амплифицировать выбранный фрагмент РНК путем синтеза комплементарной ему одноцепочечной ДНК с помощью фермента обратной транскриптазы. Затем, уже в ходе ПЦР, одноцепочечная ДНК достраивается до двуцепочечной (Рис. 6А). Этот подход широко используется для диагностики инфицирования РНК-содержащими вирусами, у которых генетический материал вместо ДНК представлен РНК (коронавирус, вирус гриппа, вирус иммунодефицита человека и др.) 19.
Но что делать, если потенциальных кандидатов-возбудителей инфекции много, а действовать надо срочно? Например, если у пациента развивается сепсис, и счет идет на часы, точно и быстро определить причину инфекции — жизненно необходимо 20. Для этого и других случаев, когда требуется детектировать в пробе не одну, а сразу несколько последовательностей, был разработан метод мультиплексной ПЦР. Чтобы получить копии нескольких последовательностей, праймеры в ПЦР-смесь добавляют с расчетом по 2 штуки на каждый амплифицируемый фрагмент (Рис. 6Б). Помимо выявления патогенов, мультиплексная ПЦР также отлично подходит для одновременного детектирования нескольких мутаций в заданных генах 21 и определения пищевого состава продуктов питания. Например, для выявления сильных пищевых аллергенов 22. Благодаря обширному диапазону приложений этот подход завоевал широкое признание среди специалистов.
Когда требуется снизить число неспецифических продуктов реакции, можно воспользоваться методом вложенной ПЦР. В этом случае амплифицируют два фрагмента: один из них — более длинный, а другой, встроенный в него, более короткий — искомый (Рис. 6В). Благодаря тому, что последовательно проводится ПЦР сначала крупного, а затем малого фрагмента, более крупный фрагмент выступает в качестве дополнительной матрицы для малого, тем самым увеличивая специфичность амплификации искомой последовательности. Метод вложенной ПЦР используют в исследованиях, требующих высокой точности результата, или для последовательностей, амплификация которых затруднена 23, 24. Хотя метод вложенной ПЦР имеет очевидные преимущества, его использование требует более детального знания целевой нуклеотидной последовательности, что не всегда возможно 25.
 Рис. 6. Принцип работы ОТ-ПЦР, мультиплексной ПЦР и вложенной ПЦР.
Рис. 6. Принцип работы ОТ-ПЦР, мультиплексной ПЦР и вложенной ПЦР.
Источник 1 >> ;
Источник 2 >> ;
Источник 3 >>
Будущее метода ПЦР
С каждым годом появляются все новые и новые молекулярно-биологические методы, но вот уже более 20 лет ПЦР был и остается одним из ключевых решений, без которого невозможно представить развитие биологических наук и медицины. Работа с генетическим материалом почти всегда ассоциирована с крайне малыми количествами исходного вещества. Поэтому ПЦР, увеличивающая это количество, часто является начальным этапом в решении самых разных биолого-медицинских задач.
Несмотря на постоянное развитие этой технологии, даже последние ПЦР-разработки сталкиваются с некоторыми методологическими проблемами
26. Например, результат ПЦР-диагностики все еще в значительной степени зависит от качества генетического материала в исходном образце. Амплификация обогащенных ГЦ-основаниями последовательностей с помощью ПЦР затруднена: из-за образования прочного химического взаимодействия, если Г и Ц часто встречаются подряд в одной цепи, они могут образовать вторичные структуры, что препятствует дальнейшему синтезу. Наконец, развитие ПЦР-технологий идет в направлении миниатюризации: создание миниатюрных ПЦР-систем станет новой вехой в клинической практике. Быть может, однажды мы сможем купить такой тест даже в аптеке!
Литература
1. Higuchi R., Dollinger G., Walsh P.S., Griffith R. Simultaneous amplification and detection of specific DNA sequences. Biotechnology, 1992.
2. Valasek M.A., Repa J.J. The power of real-time PCR. Advances in Physiology Education, 2005.
3. Dragan A.I. et al. SYBR Green I: fluorescence properties and interaction with DNA. Journal of Fluorescence, 2012.
4. Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols, 2008.
5. Salihah N.T., Hossain M.M., Lubis H., Ahmed M.U. Trends and advances in food analysis by real-time polymerase chain reaction. Journal of Food Science and Technology, 2016.
6. Hoy M.A. DNA amplification by the polymerase chain reaction. Insect Molecular Genetics, 2013.
7. Ma J., Li N., Guarnera M., Jiang F. Quantification of plasma miRNAs by digital PCR for cancer diagnosis. Biomarker Insights, 2013.
8. Perkins G., Lu H., Garlan F., Taly V. Droplet-based digital PCR: application in cancer research. Advances in Clinical Chemistry, 2017.
9. Gaňová M. et al. Multiplexed digital polymerase chain reaction as a powerful diagnostic tool. Biosensors and Bioelectronics, 2021.
10. Böger B. et al. Systematic review with meta-analysis of the accuracy of diagnostic tests for COVID-19. American Journal of Infection Control, 2021.
11. Xu J. et al. Digital droplet PCR for SARS-CoV-2 resolves borderline cases. American Journal of Clinical Pathology, 2021.
12. Perez-Lopez B., Mir M. Commercialized diagnostic technologies to combat SARS-CoV2: advantages and disadvantages. Talanta, 2021.
13. Li J. et al. Comparison of reverse-transcription qPCR and droplet digital PCR for the detection of SARS-CoV-2 in clinical specimens of hospitalized patients. Diagnostic Microbiology and Infectious Disease, 2022.
14. Demeke T., Dobnik D. Critical assessment of digital PCR for the detection and quantification of genetically modified organisms. Analytical and Bioanalytical Chemistry, 2018.
15. Lu R. et al. Retrospective quantitative detection of SARS-CoV-2 by digital PCR showing high accuracy for low viral load specimens. The Journal of Infection in Developing Countries, 2022.
16. Suo T. et al. ddPCR: a more accurate tool for SARS-CoV-2 detection in low viral load specimens. Emerging Microbes & Infections, 2020.
17. Zhou L. et al. Breath-, air-and surface-borne SARS-CoV-2 in hospitals. Journal of Aerosol Science, 2021.
18. Wang Y. et al. Anti-PADI4 antibody suppresses breast cancer by repressing the citrullinated fibronectin in the tumor microenvironment. Biomedicine & Pharmacotherapy, 2022.
19. Bustin S.A., Mueller R. Real-time reverse transcription PCR (qRT-PCR) and its potential use in clinical diagnosis. Clinical Science, 2005.
20. Ziegler I., Fagerström A., Strålin K., Mölling P. Evaluation of a commercial multiplex PCR assay for detection of pathogen DNA in blood from patients with suspected sepsis. PloS one, 2016.
21. Ståhlberg A. et al. Simple, multiplexed, PCR-based barcoding of DNA enables sensitive mutation detection in liquid biopsies using sequencing. Nucleic Acids Research, 2016.
22. Suh S.M. et al. A multiplex PCR assay combined with capillary electrophoresis for the simultaneous detection of tropomyosin allergens from oyster, mussel, abalone, and clam mollusk species. Food Chemistry, 2020.
23. Liu L. et al. A rapid nested polymerase chain reaction method to detect circulating cancer cells in breast cancer patients using multiple marker genes. Oncology Letters, 2014.
24. Tawe L. et al. Molecular detection of human papillomavirus (HPV) in highly fragmented DNA from cervical cancer biopsies using double-nested PCR. MethodsX, 2018.
25. Rahman M.T. et al. Polymerase chain reaction (PCR): a short review. Anwer Khan Modern Medical College Journal, 2013.
26. Zhu H. et al. PCR past, present and future. BioTechniques, 2020.




.jpg)