- О компании
- Решения и приложения
-
Направления деятельности
- Интернет-магазин
-
Медиатека
СтатьиСервис

10.06.2025
Сервисная сторона лаборатории: от инсталляции оборудования до постгарантийной поддержки
Интервью со специалистами технической поддержки Компании Хеликон.
СтатьиИнтервью
27.03.2024
Интервью Анатолия Смирнова телеканалу PROБизнес
«В любой биологической лаборатории в России есть что-то от нас».
- Новости
- Мероприятия
- Партнеры
О компании
Решения и приложения
- Главная страница
- Медиатека
- Информационные статьи
- Новое исследование геномов опухолей может пролить свет на происхождение рака: поддержка Компании Хеликон
Медиатека
Новое исследование геномов опухолей может пролить свет на происхождение рака
Оглавление:
•
Что удалось обнаружить?
•
Как можно использовать полученные данные?
В 2022 году Всемирная организация здравоохранения оценила бремя рака в 19,3 миллиона новых случаев и 10,0 миллионов смертей в год. Рак является одной из ведущих причин смертности в мире1,2, но его генетические истоки до сих пор не до конца изучены.
Раковый геном содержит огромное количество мутаций, но лишь часть из них способствует развитию именно злокачественной опухоли. Такие «мутационные сигнатуры» — характерный набор мутаций, сопровождающих рак, — могут дать представление об экзо- и эндогенных причинах заболевания. Тщательное изучение раковых геномов может пролить свет на факторы онкогенеза и помочь в поиске новых методов лечения.
Именно такое исследование описано в статье, опубликованной в журнале Science 21 апреля 2022 г3. Ученые проанализировали сотни миллионов мутаций, скрывающихся в геномах 19 типов раковых опухолей. Из 19840 образцов 12 222 были собраны с помощью полногеномного секвенирования Национальной службой здравоохранения Великобритании (NHS) для проекта 100 000 геномов. Для проверки результатов авторы провели независимый анализ данных двух ранее опубликованных наборов данных: 3001 геномов от Международного консорциума генома рака (ICGC) и 3417 от Медицинского фонда Хартвига (HMF).
Это не первое исследование такого плана, однако оно крупнейшее в своем роде на сегодняшний день.
В новой работе удалось выявить редкие мутационные паттерны, которые встречаются в ≤1% опухолей и которые невозможно было бы выделить из небольших наборов данных. Авторы добавили десятки новых записей в медленно пополняющийся список мутационных сигнатур, которые могут стать ключом к понимаю генетических и экологических причин рака.
Такой масштаб потребовал разработки новых аналитических инструментов и метода, способного обрабатывать большое количество информации. Осознавая постоянно растущие объёмы информации и сложность данных, авторы статьи разработали алгоритм Signature Fit Multi-Step (FitMS), чтобы помочь обычным пользователям точно идентифицировать мутационные процессы при анализе новых образцов. Они ввели понятие общих и редких сигнатур: на первом этапе FitMS оценивает наличие общих, часто встречающихся сигнатур, а на втором определяет, присутствуют ли также дополнительные, редкие сигнатуры.
Что удалось обнаружить?
В работе идентифицировали 82 сигнатуры с заменой одного основания (single-base substitution, SBS) и 27 — с заменой двух оснований (double-base substitution, DBS). Из них 40 SBS и 18 DBS ранее не были и описаны.
Авторы сравнили 16 типов тканей, которые присутствовали во всех 3 наборах, и обнаружили, что сигнатуры одного и того же органа в разных наборах были больше похожи друг на друга, чем на сигнатуры других типов тканей. То есть один и тот же биологический процесс может порождать разные мутационные паттерны в разных тканях. Это доказывает, что мутационные сигнатуры в каждом органе воспроизводимы, имеют тканевую специфичность и поддаются обнаружению, независимо от платформы секвенирования или причины вызова мутаций, считают авторы исследования.
Также оказалось, что количество общих сигнатур в каждом органе обычно ограничено (от 5 до 10 для SBS) и не зависит от количества анализируемых образцов, тогда как количество редких сигнатур прямо пропорционально размеру набора данных. Это объясняет, почему общие сигнатуры обнаруживаются даже при ограниченном количестве полных геномов, тогда как шансы обнаружить редкие повышаются при увеличении размера выборки.
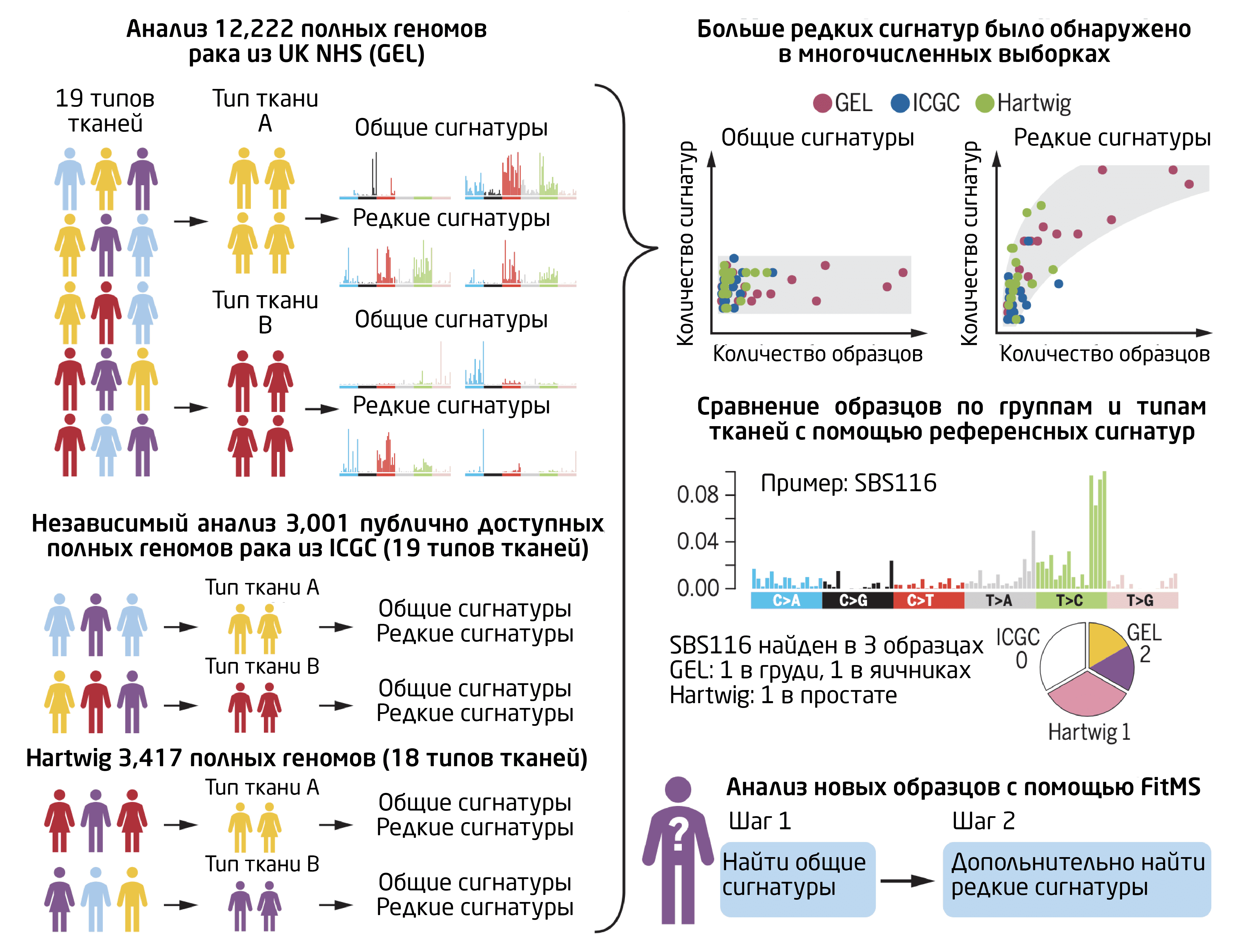
Рис.1. Открытие и применение общих и редких мутационных сигнатур в процессе анализа. Источник >>
Как можно использовать полученные данные?
Некоторые агенты, вызывающие рак, создают характерные паттерны изменений ДНК. Поэтому выявленные сигнатуры можно проследить до конкретных мутационных процессов, вызванных как эндогенными факторами, так и окружающей средой. Эта информация крайне важна для предотвращения и лечения рака.
Например, при описании эндогенных процессов важным фактором являются нарушения репарации ДНК. Недавно было продемонстрировано, что сигнатуры, определяемые высокими пиками замены цитозина на аденин (C>A) в GCA, ACA, GCT и TCT, обусловлены избытком фермента репарации OGG1 (8-оксогуанин-ДНК-гликозилазы). Авторы также отмечают, что дезаминирование — еще одна причина мутагенеза — может быть охарактеризовано заменой цитозина на тимин (C>T) в CpG сайтах. Ультрафиолетовый свет, как экзогенный фактор развития раковой опухоли, также может вызывать C>T замену в определенных участках генома — такие изменения часто встречаются при меланомах.
К сожалению, многие из описанных мутационных сигнатур пока не имеют известной этиологии. Это неудивительно — они часто являются результатом нескольких событий, произошедших одновременно, поэтому невозможно сказать, что именно послужило причиной изменений.
Поиск новых мутационных сигнатур и их изучение все еще продолжается. С их помощью можно понять, что привело к развитию опухоли, и найти новые мишени для терапии. Эти исследования чрезвычайно важны для понимания причин заболевания и разработки методов лечения.
Литература
1. Cancer. World Health Organization, 2022.
2. Sung H. et. al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 2021.
3. Degasperi A. et al. Substitution mutational signatures in whole-genome–sequenced cancers in the UK population. Science, 2022.




.jpg)