Медиатека
Как мозг реагирует на стресс? Возможности адаптации
Оглавление:
•
Как мозг воспринимает стресс?
•
Роль воспаления в развитии стресс-ассоциированных расстройств
•
Микроглия и стресс: возможности адаптации
•
Влияние стресса на микроглию: данные экспериментальных исследований
•
Примеры других стрессорных воздействий: депривация сна
В современном мире проблема психических и соматических расстройств, связанных со стрессом, становится все более актуальной. С одной стороны, стресс – это важнейший эволюционный механизм, необходимый для адаптации организма к меняющимся условиям окружающей среды. С другой – длительное воздействие стрессогенных факторов может приводить к истощению физических ресурсов организма и развитию коморбидных (сопутствующих) нарушений. В первую очередь, это связано с запуском защитных и адаптивных реакций на клеточном, физиологическом и поведенческом уровнях. В основе восприятия стрессорных стимулов и, как результат, адаптации лежит многоступенчатое взаимодействие структур центральной нервной системы (ЦНС) и периферических систем органов, в том числе иммунной системы. Главным «связующим звеном» этого взаимодействия являются специальные клетки иммунного происхождения – микроглия.
В зависимости от условий окружающей среды и характера стрессогенного воздействия, клетки микроглии могут приобретать различные морфофункциональные фенотипы, демонстрируя удивительную «гибкость» адаптационного ответа. Какие механизмы отвечают за адаптацию мозга к стрессу как на клеточном, так и на системном уровнях – обсудим в статье.
Как мозг воспринимает стресс?
В головном мозге в восприятии стрессорных стимулов участвуют структуры лимбической системы (миндалина, префронтальная кора, гиппокамп и гипоталамус), связанные с высшими когнитивными функциями, например, эмоциональной памятью и обучением, ассоциированным с угрожающим стимулом (fear-conditioned learning) 1. Они передают сигнал об опасности в главный центр вегетативной и эндокринной регуляции и контроля гомеостаза – гипоталамус. Повышение уровня гормонов гипоталамуса – вазопрессина и кортикотропин-рилизинг-гормона (кортиколиберина) – приводит к активации гипоталамо-гипофизарно-надпочечниковой оси и увеличению синтеза адренокортикотропных гормонов гипофиза и глюкокортикоидных гормонов коры надпочечников (преимущественно кортизола у людей и кортикостерона у грызунов). Наконец, выделение в кровоток катехоламинов (адреналин, норадреналин, дофамин) оказывает активирующее действие на организм и запускает так называемую реакцию «бей или беги» (fight or flight) 2- 4. Она заключается в мобилизации энергетических ресурсов организма в ответ на воздействие угрожающего стимула: активируется метаболизм глюкозы и жиров и повышается их доставка в мышцы, увеличивается частота дыхания и сердечных сокращений 5. Однако в патогенезе стресс-ассоциированных заболеваний главную роль играет другой механизм – гиперактивация иммунной системы и повышение уровня гормонов и медиаторов воспаления 2, которые приводят к развитию системного и нейровоспаления 6, 7.
Роль воспаления в развитии стресс-ассоциированных расстройств
На ключевую роль нейровоспаления в патогенезе заболеваний, связанных со стрессом, указывают результаты многочисленных исследований. Например, повышение уровня провоспалительных цитокинов в периферической крови и ЦНС было обнаружено у пациентов с депрессией 8, а также у животных в экспериментальных моделях депрессивного расстройства 9 и хронического стресса 10. Так, длительный стресс становится независимым фактором риска развития сопутствующих психических и соматовегетативных нарушений.
Микроглия и стресс: возможности адаптации
«Коммуникация» между мозгом и иммунной системой обеспечивается единственными в ЦНС клетками миелоидного происхождения – микроглией, на которую приходится от 5% до 20% от всех глиальных клеток паренхимы головного и спинного мозга 11. Клетки микроглии образуются из примитивных макрофагов желточного мешка и попадают в мозг на ранней стадии эмбрионального развития 12. В постнатальном периоде микроглия участвует в регуляции формирования дендритных шипиков и синаптической пластичности 13, а во взрослом мозге обеспечивает поддержание гомеостаза микросреды 14, процессов памяти, синаптической пластичности 15, 16 и нейрогенеза 17. При травме головного мозга микроглия также выполняет ряд защитных функций. Например, она способна фагоцитировать как здоровые взрослые (например, в процессе забывания) 15, так и поврежденные синапсы 16.
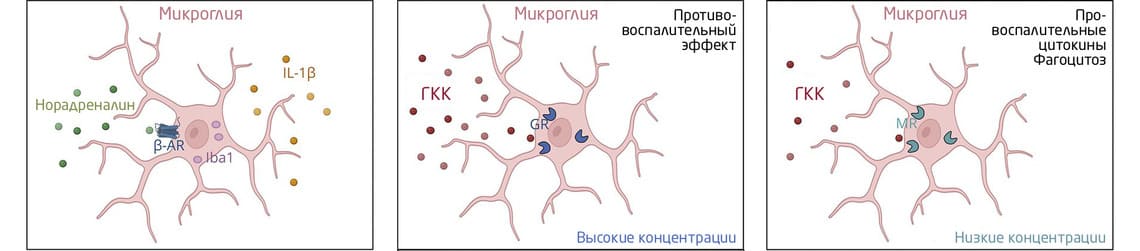
В зависимости от физиологических условий микроглия может приобретать различные морфологические и функциональные характеристики (фенотипы): в состоянии покоя клетки имеют разветвленную морфологию с короткими и тонкими отростками (покоящаяся форма), а при неблагоприятном воздействии приобретают амебовидную или реактивную форму (Рис. 1) 18. Последняя представляет особый интерес для медицинской науки.
«Реактивная» микроглия формируется в ответ на острый (однократный) и хронический стресс 19 и характеризуется измененной морфологией клеток, аномальным фагоцитозом, повышенной подвижностью и высвобождением провоспалительных цитокинов 19, 20. В ответ на острый стресс повышается доля клеток с увеличенной площадью сомы и более короткими отростками, которые впоследствии начинают экспрессировать апоптотические маркеры 21. При хроническом стрессе, наоборот, наблюдается повышенная рамификация (разветвленность) клеток и увеличение длины отростков 18, 22, 23.
Влияние гормонов стресса – катехоламинов и глюкокортикоидов – на формирование нейрофизиологического ответа на стресс также во многом определяется их действием на микроглию. Например, в норме активация β-адренорецепторов (рецепторов к адреналину) снижает экспрессию провоспалительных цитокинов и высвобождение активных форм кислорода клетками 24- 26. В условиях стресса повышенное выделение норадреналина нейронами голубого пятна и впоследствии другими структурами мозга, а также стимуляция адренергических рецепторов, наоборот, приводят к активации микроглии и усилению нейровоспаления 27, 28. Дополнительно приобретению микроглией реактивного фенотипа способствует провоспалительное действие цитокинов и других факторов, выделяемых клетками мозга в ответ на стресс. С глюкокортикоидами все не так однозначно: их эффект на микроглию может иметь разную направленность и во многом определяется физиологическим состоянием ее микроокружения 29.
В зависимости от концентрации глюкокортикоидные гормоны могут оказывать про- или противовоспалительное действие (Рис. 1) 29. При низких и умеренных уровнях они связываются преимущественно с минералокортикоидными рецепторами, стимулируют продукцию провоспалительных цитокинов и экспрессию универсального фактора транскрипции NF-κB (участвует в контроле экспрессии генов иммунного ответа, апоптоза и клеточного цикла). При высоких концентрациях глюкокортикоиды связываются с глюкокортикоидными рецепторами и оказывают противовоспалительное действие 30- 33.
Рис. 1. Влияние гормонов симпатоадреналовой оси на активность микроглии. (А) В условиях стресса повышенное высвобождение норадреналина из голубого пятна приводит к активации β-адренорецепторов (β-AR) и индукции нейровоспаления, сопровождающегося повышением экспрессии Iba1 в микроглии и повышением уровня IL1β в головном мозге. Вместе с CD11b и ICAM-1, Iba1, ионизированная кальций-связывающая адаптерная молекула 1, служит чувствительным маркером активации микроглии 34, 35. Высвобождаемые в ответ на стресс глюкокортикоидные гормоны связываются с глюкокортикоидными (GR) и минералокортикоидными (MR) рецепторами на поверхности клеток микроглии. При больших концентрациях глюкокортикоиды связываются преимущественно с глюкокортикоидными рецепторами. Если микроглия находится в состоянии покоя, гормоны снижают продукцию цитокинов клетками микроглии и оказывают противовоспалительный эффект. При низких концентрациях глюкокортикоиды активируют преимущественно минералокортикоидные рецепторы, способствуя увеличению продукции провоспалительных цитокинов и активации фагоцитоза. 24
Наконец, показана роль толл-подобных рецепторов (TLR) в активации микроглии. Они принадлежат семейству рецепторов распознавания образов и способны распознавать как чужеродные паттерны, ассоциированные с внешними патогенами, так и связанные с повреждением эндогенные молекулярные паттерны (damage-associated molecular patterns, DAMPs) (Рис. 2) 24, 36, 37.
Рис. 2. Активация фагоцитоза в реактивной микроглие. Воздействие хронического стресса приводит к гиперактивации симпатической нервной системы и структур головного мозга, участвующих в регуляции ответа на стресс. В ответ на повышение секреции глюкокортикостероидов, норадреналина и адреналина надпочечниками и активацию иммунной системы клетки микроглии начинают экспрессировать специфические маркеры Iba1, CD11b, CD86, TLR4, CD14 и CD68. Высвобождение провоспалительных цитокинов IL-1β и CCL2 способствует повышению образования активных форм кислорода и прогрессированию нейровоспаления. АФК – активные формы кислорода; CCL2 – хемокиновый (мотив СС) лиганд 2 (цитокин группы β-хемокинов); TLR – толл-подобные рецепторы. 24
Активированное состояние микроглии и повышенная экспрессия генов, связанных с иммунными каскадами (например, IL-1β, IL-6 и CD14 41), сохраняется до 24 дней после последнего воздействия стрессогенного фактора 24.
Влияние стресса на микроглию: данные экспериментальных исследований
1. Экспериментальный дизайн
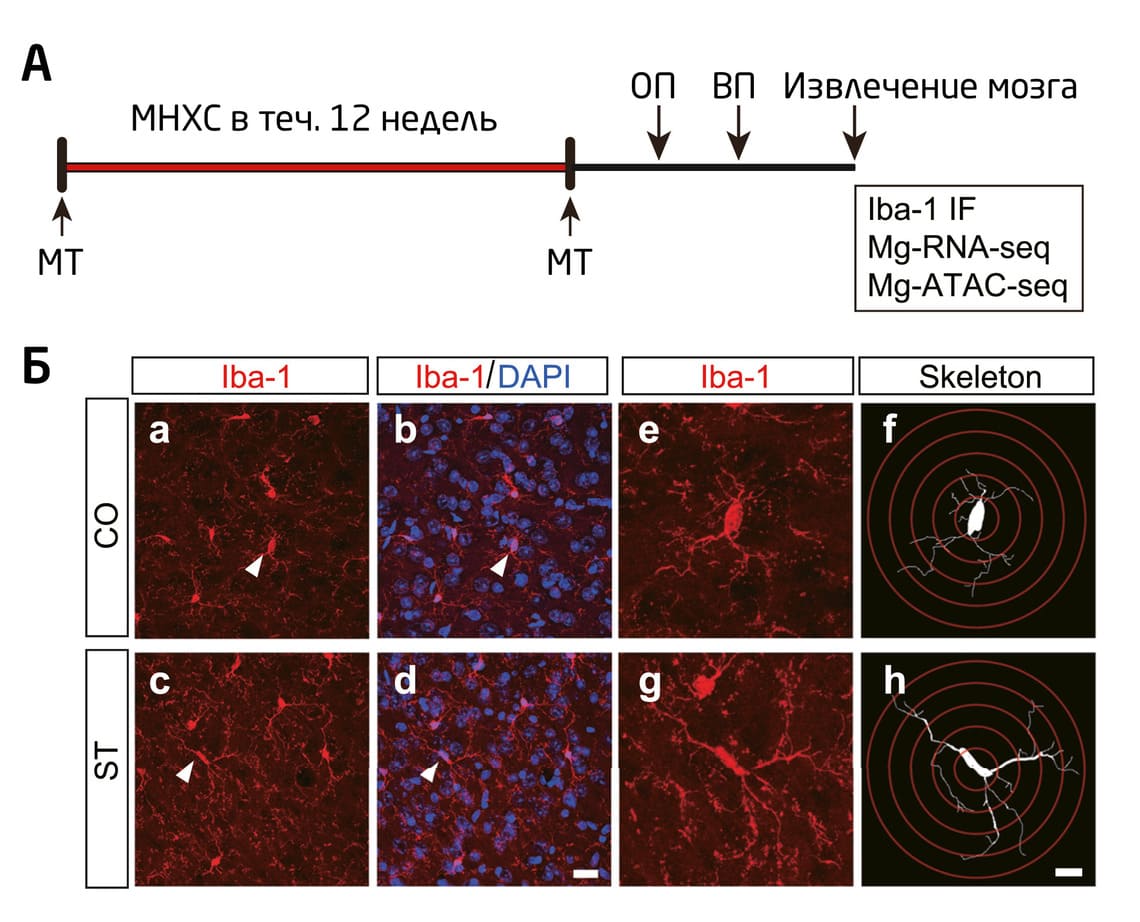
Влияние стресса на морфологические и функциональные изменения в микроглии изучили исследователи из Университет Фудань в Китае 38. Ученые использовали экспериментальную модель мягкого непредсказуемого хронического стресса, максимально приближенную к реальным условиям: она позволяет «реконструировать» воздействие регулярного умеренного стресса – например, социального – на человека. В качестве стрессоров использовали нахождение в тесной клетке (эффект скученности), иммобилизацию (ограничение движения), мягкое холодовое воздействие, частое изменение светового режима и т.д. Тревожное и депрессивное поведение мышей, а также морфологические изменения в клетках микроглии (практически во всех областях мозга, кроме обонятельной луковицы и мозжечка) авторы работы оценивали спустя 12 недель ежедневного стрессогенного воздействия. Эксперимент проводили на самцах в связи с более «ярко выраженными» у них клеточными фенотипами микроглии (Рис. 3) 39–41.
1. Выделение микроглии и РНК.
Суспензию одиночных клеток инкубировали с антителами против CD11b, пропускали через разделительную колонку и инкубировали с моноклональным антителом против CD11b-FITC. Полученные клетки анализировали с помощью метода проточной цитометрии. Экстракцию РНК проводили в лизированных клетках посредством инкубации с ДНКазой I.
2. Изучение экспрессии генов основных популяций клеток в мозге.
Количественная ПЦР в реальном времени. Перед проведением ПЦР РНК подвергали обратной транскрипции. Для ПЦР были отобраны специфичные для каждого типа клеток гены: Aif1, Itgam, Cx3cr1, Hexb, P2ry12 (микроглия); Mbp (олигодендроциты); Grin2b, Rbfox3, Map2 (нейроны); S100β, Gfap, Slc1a3 (астроциты).
3. Секвенирование генома микроглии.
3.1. Подготовка библиотеки RNA-seq.
После подготовки библиотек RNA-seq на основе тотальной РНК проводили секвенирование целевых последовательностей.
3.2. Подготовка библиотеки ATAC-seq.
После гомогенизировали в лизирующем буфере ядра микроглии собирали с помощью центрифугирования. Далее с использованием набора для гель-экстракции ДНК выделяли из ядер и проводили ПЦР. Размер ДНК для библиотеки варьировался от 150 до 500 п.н.
4. Анализ уровней ИФН-α, ИФН-β и ИНФ-γ в мозге животных. Иммуноферментный анализ.
Концентрацию IFN-α, IFN-β и IFN-γ в мозге и селезенке мышей измеряли с использованием наборов ELISA. Дополнительно определяли концентрацию общего белка.
Поведение животных оценивали с помощью тестов «Открытое поле» и «Вынужденное плавание».
Рис. 3. (А) Схема эксперимента Zhang et al. 38 (Б) Иммунофлуоресцентное окрашивание анти-Iba1 в префронтальной коре. Масштаб: 20 мкм a–d, 10 мкм e–h. МНХС – мягкий непредсказуемый хронический стресс; ОП – поведенческий тест открытое поле 42; ВП – поведенческий тест вынужденное плавание 43; МТ – измерение массы тела; ST – стрессогенное воздействие; CO – контрольная группа; Mg-RNA-seq и Mg-ATCA-seq – специфичные для микроглии последовательности.
2. Результаты исследования
Воздействие хронического стресса в течение 12 недель приводило к изменению морфологии клеток микроглии в префронтальной коре мозга, увеличивались количество и длина их отростков. Аналогичные изменения ученые обнаружили и в других структурах лимбической системы – зубчатой извилине, гиппокампе и миндалине. В субпопуляции клеток «интерфероновой микроглии» (одной из шести субпопуляций микроглии 44) была снижена транскрипция интерферон(ИФН)-регулируемых генов (interferon-regulated genes, IFG), участвующих в иммунных каскадах. При этом экспрессия самих интерферонов оставалась на прежнем уровне. Таким образом, хотя длительный стресс не влиял на синтез самого интерферона ИФН-β, он приводил к снижению экспрессии генов других интерферонов, в том числе провоспалительных интерферонов I типа и звеньев ИФН-γ-опосредованного сигнального каскада (противовоспалительные интерфероны II типа) 38.
ИФН-β представляет собой цитокин, который высвобождается клетками врожденного иммунитета (макрофаги и дендритные клетки) и некоторыми неиммунными клетками (фибробласты и эпителиальные клетки). Он может оказывать как противовоспалительный, так и провоспалительный эффекты и участвует в регуляции практически всех звеньев врожденного и адаптивного иммунного ответа 45. В то время как аномально высокое образование интерферонов вызывает нарушение регуляции соответствующих сигнальных механизмов 46, отсутствие изменений их уровня в головном мозге и селезенке на фоне снижения экспрессии ИФН-регулируемых генов может говорить о наличии еще одного фенотипа микроглии. Этот фенотип формируется при нарушениях «внутреннего» иммунитета клеток и не зависит от интерфероновых каскадов. Интересно, что данный механизм также был найден в стволовых клетках 47.
В некоторых кластерах ИФН-регулируемых генов помимо подавления их экспрессии также может наблюдаться снижение транскрипции некоторых повторов ДНК, включая одну из наиболее распространенных последовательностей в геноме человека L1.L1 (до 17% генома). Последовательности L1 принадлежат семейству родственных мобильных элементов класса I (длинные вкрапленные ядерные элементы, подсемейство ретротранспозонов) 29 и играют важную роль в возникновении геномных полиморфизмов и разнообразии клеток 49. Данные о влиянии стресса на транскрипцию повторов L1 противоречивы. С одной стороны, транскрипция повторов L1 в нейронах повышается у животных, которые подвергались стрессу в раннем возрасте 50. С другой стороны, хроническое воздействие стресса во взрослом возрасте приводило к снижению транскрипции некоторых повторов ДНК, хотя большинство из них располагалось вблизи генов со сниженной экспрессией 38.
Примеры других стрессорных воздействий: депривация сна
Аналогичное влияние на микроглию оказывает и другой тип стрессорного воздействия – депривация сна. Кратковременная (6 часов) острая депривация сна приводит к повышению высвобождения цитокинов и увеличению рамификации клеток микроглии в мозге животных 51. Последнее, по всей видимости, служит компенсаторным механизмом, который помогает сформировать больше функциональных связей с микроокружением – синапсами и соседними клетками. В период восстановления после ограничения сна микроглия участвует в восстановление нервной ткани – регуляции синаптического гомеостаза и памяти 51.
При длительной хронической депривации сна (до 5 дней подряд) клетки микроглии принимают амебоидную, дерамифицированную или лишенную отростков форму 52. Это, по всей видимости, отражает другой тип поведения, который можно обнаружить при тяжелых поражениях ЦНС, а не «гомеостатические» или «стабилизирующие» реакции мозга на подобный вид стрессорного воздействия 51.
На уровне генома депривация сна приводит к изменению экспрессии генов, связанных с модуляцией активности нейронов, синаптической пластичности, транскрипции и трансляции 53- 55. Например, у мышей без микроглии отсутствие сна приводит к изменению морфологических характеристик нейронов – снижению плотности дендритных шипиков и зрелых синапсов в области СА3 гиппокампа. В то же время, у здоровых животных их плотность, наоборот, повышается 51. Таким образом, можно предположить, что при недостатке сна микроглия оказывает положительное действие на окружающие клетки – участвует в стабилизации физиологического микроокружения и функционального состояния нейронов, а не инициирует воспалительные или другие патологические иммунные процессы.
Адаптация – сложный многогранный процесс, который затрагивает все уровни живого организма – от мозга до клетки и наоборот. Мозг первым воспринимает сигнал об опасности и запускает каскад психофизиологических, нейрохимических и молекулярно-генетических реакций. Через посредников – иммунную и эндокринную системы – сигнал передается и детектируется клетками микроглии. По механизму положительной или отрицательной обратной связи именно они и определяют, каким будет дальнейший системный ответ на стресс. Все это снова поднимает фундаментальные вопросы о том, в какой степени психофизиологические характеристики организма определяются тонкими молекулярно-генетическими процессами, а в какой – внешними воздействиями.
Литература
1. Shechner T. et al. Fear conditioning and extinction across development: Evidence from human studies and animal models. Biological psychology, 2014.
2. Godoy L.D. et al. A Comprehensive Overview on Stress Neurobiology: Basic Concepts and Clinical Implications. Frontiers in Behavioral Neuroscience, 2018.
3. Ouguerram K. et al. A new labeling approach using stable isotopes to study in vivo plasma cholesterol metabolism in humans. Metabolism, 2002.
4. Spencer R.L., Deak T. A users guide to HPA axis research. Physiology & Behavior, 2017.
5. Roelofs K. Freeze for action: neurobiological mechanisms in animal and human freezing. Philosophical Transactions of the Royal Society B: Biological Sciences. Royal Society, 2017.
6. Tynan R.J. et al. Chronic stress alters the density and morphology of microglia in a subset of stress-responsive brain regions. Brain, Behavior, and Immunity, 2010.
7. Maier S.F. Bi-directional immune-brain communication: Implications for understanding stress, pain, and cognition. Brain, Behavior, and Immunity, 2003.
8. Tonelli L.H. et al. Elevated cytokine expression in the orbitofrontal cortex of victims of suicide. Acta Psychiatrica Scandinavica, 2008.
9. O’Connor K.A. et al. Peripheral and central proinflammatory cytokine response to a severe acute stressor. Brain Research, 2003.
10. Tripathi A. et al. Type 1 interferon mediates chronic stress-induced neuroinflammation and behavioral deficits via complement component 3-dependent pathway. Molecular Psychiatry, 2021.
11. Perry V.H. A revised view of the central nervous system microenvironment and major histocompatibility complex class II antigen presentation. Journal of Neuroimmunology, 1998.
12. Ginhoux F. et al. Origin and differentiation of microglia. Frontiers in Cellular Neuroscience, 2013.
13. Hong S., Dissing-Olesen L., Stevens B. New insights on the role of microglia in synaptic pruning in health and disease. Current Opinion in Neurobiology, 2016.
14. Han J., Harris R.A., Zhang X.-M. An updated assessment of microglia depletion: current concepts and future directions. Molecular Brain, 2017.
15. Wang C. et al. Microglia mediate forgetting via complement-dependent synaptic elimination, Science. American Association for the Advancement of Science, 2020.
16. Galloway D.A. et al. Phagocytosis in the Brain: Homeostasis and Disease. Frontiers in Immunology, 2019.
17. Ji K., Miyauchi J., Tsirka S.E. Microglia: An Active Player in the Regulation of Synaptic Activity. Neural Plasticity, 2013.
18. Boche D., Perry V.H., Nicoll J.А.R. Review: Activation patterns of microglia and their identification in the human brain. Neuropathology and Applied Neurobiology, 2013.
19. Rohleder N. Stress and inflammation – The need to address the gap in the transition between acute and chronic stress effects. Psychoneuroendocrinology, 2019.
20. Hammen C. et al. Chronic and acute stress and the prediction of major depression in women. Depression and Anxiety, 2009.
21. Kreisel T. et al. Dynamic microglial alterations underlie stress-induced depressive-like behavior and suppressed neurogenesis. Molecular Psychiatry, 2014.
22. Hinwood M. et al. Chronic Stress Induced Remodeling of the Prefrontal Cortex: Structural Re-Organization of Microglia and the Inhibitory Effect of Minocycline. Cerebral Cortex, 2013.
23. Xie J. et al. Inhibition of phosphodiesterase-4 suppresses HMGB1/RAGE signaling pathway and NLRP3 inflammasome activation in mice exposed to chronic unpredictable mild stress. Brain, Behavior, and Immunity, 2021.
24. Schramm E., Waisman A. Microglia as Central Protagonists in the Chronic Stress Response. Neurology Neuroimmunology & Neuroinflammation, 2022.
25. Tynan R.J. et al. A comparative examination of the anti-inflammatory effects of SSRI and SNRI antidepressants on LPS stimulated microglia. Brain, Behavior, and Immunity, 2012.
26. Colton C.A., Chernyshev O.N. Inhibition of microglial superoxide anion production by isoproterenol and dexamethasone. Neurochemistry International, 1996.
27. Benarroch E.E. The locus ceruleus norepinephrine system: functional organization and potential clinical significance. Neurology, 2009.
28. Johnson J.D. et al. Catecholamines mediate stress-induced increases in peripheral and central inflammatory cytokines. Neuroscience, 2005.
29. Cain D.W., Cidlowski J.A. Immune regulation by glucocorticoids. Nature reviews. Immunology, 2017.
30. Chantong B. et al. Mineralocorticoid and glucocorticoid receptors differentially regulate NF-kappaB activity and pro-inflammatory cytokine production in murine BV-2 microglial cells. Journal of Neuroinflammation, 2012.
31. Liu J. et al. Corticosterone Preexposure Increases NF-κB Translocation and Sensitizes IL-1β Responses in BV2 Microglia-Like Cells. Frontiers in Immunology, 2018.
32. Munhoz C.D. et al. Glucocorticoids Exacerbate Lipopolysaccharide-Induced Signaling in the Frontal Cortex and Hippocampus in a Dose-Dependent Manner. The Journal of Neuroscience, 2010.
33. Gomez-Sanchez E., Gomez-Sanchez C.E. The multifaceted mineralocorticoid receptor. Comprehensive Physiology, 2014.
34. Shi F.-J. et al. Is Iba-1 protein expression a sensitive marker for microglia activation in experimental diabetic retinopathy. International Journal of Ophthalmology, 2021.
35. Imai Y. et al. A novel gene iba1 in the major histocompatibility complex class III region encoding an EF hand protein expressed in a monocytic lineage. Biochemical and Biophysical Research Communications, 1996.
36. Ifuku M. et al. Activation of Toll-like receptor 5 in microglia modulates their function and triggers neuronal injury. Acta Neuropathologica Communications, 2020.
37. Heidari A., Yazdanpanah N., Rezaei N. The role of Toll-like receptors and neuroinflammation in Parkinson’s disease. Journal of Neuroinflammation, 2022.
38. Zhang Y. et al. Microglia-specific transcriptional repression of interferon-regulated genes after prolonged stress in mice. Neurobiology of Stress, 2022.
39. Labonté B. et al. Sex-specific transcriptional signatures in human depression. Nature Medicine, 2017.
40. Bollinger J.L. Uncovering microglial pathways driving sex-specific neurobiological effects in stress and depression. Brain, Behavior, & Immunity, 2021.
41. Lenz K.M., McCarthy M.M. A Starring Role for Microglia in Brain Sex Differences. Neuroscientist, 2015.
42. Kraeuter A.-K., Guest P.C., Sarnyai Z. The Open Field Test for Measuring Locomotor Activity and Anxiety-Like Behavior. Methods in Molecular Biology, 2019.
43. Can A. et al. The Mouse Forced Swim Test. Journal of Visualized Experiments, 2012.
44. Ndoja A. et al. Ubiquitin Ligase COP1 Suppresses Neuroinflammation by Degrading c/EBPβ in Microglia. Cell, 2020.
45. Bolívar S. et al. IFN-β Plays Both Pro- and Anti-inflammatory Roles in the Rat Cardiac Fibroblast Through Differential STAT Protein Activation. Frontiers in Pharmacology, 2018.
46. Ivashkiv L.B., Donlin L.T. Regulation of type I interferon responses. Nature Reviews Immunology, 2014.
47. Wu X. et al. Intrinsic Immunity Shapes Viral Resistance of Stem Cells. Cell, 2018.
48. Gilchrist M. et al. Systems biology approaches identify ATF3 as a negative regulator of Toll-like receptor 4. Nature, 2006.
49. Suarez N.A., Macia A., Muotri A.R. LINE-1 retrotransposons in healthy and diseased human brain. Developmental Neurobiology, 2018.
50. Cuarenta A. et al. Early life stress increases Line1 within the developing brain in a sex-dependent manner. Brain Research, 2020.
51. Gentry N.W. et al. Microglia are involved in the protection of memories formed during sleep deprivation. Neurobiology of Sleep and Circadian Rhythms, 2022.
52. Wadhwa M. et al. Inhibiting the microglia activation improves the spatial memory and adult neurogenesis in rat hippocampus during 48 h of sleep deprivation. Journal of Neuroinflammation, 2017.
53. Gaine M.E. et al. Altered hippocampal transcriptome dynamics following sleep deprivation. Molecular Brain, 2021.
54. Hor C.N. et al. Sleep–wake-driven and circadian contributions to daily rhythms in gene expression and chromatin accessibility in the murine cortex. Proceedings of the National Academy of Sciences, 2019.
55. Vecsey C.G. et al. Genomic analysis of sleep deprivation reveals translational regulation in the hippocampus. Physiological Genomics, 2012.




.jpg)