Медиатека
Искра жизни: роль биоэлектричества в формировании биологических систем
Оглавление:
• Биоэлектричество
• Потенциал покоя
• Потенциал действия
• Роль электричества в организме
• Что ещё контролирует биоэлектричество?
• Электрический угорь
Электрические явления наблюдались на протяжении веков, однако вплоть до XVII столетия они не были объединены в единую теорию. Когда эксперимент Бенджамина Франклина проложил путь к пониманию электричества как «нематериальной жидкости», которую можно собирать и изучать, люди начали задаваться вопросом, не содержится ли эта «жидкость» и в организме животных? Данная идея получила первое подтверждение благодаря экспериментам Джона Уолша с электрическим угрём, которые поддерживал сам Франклин. 1, 2 И, хотя получить прямые доказательства связи между «рыбьим электричеством» и человеческим организмом не удалось, зародилась идея о том, что мы, как и угорь, тоже можем производить электричество.
Тернистый путь развития электрофизиологии как науки по-настоящему начался в 1780 году, когда итальянский учёный Луиджи Гальвани создал домашнюю лабораторию, оснащённую новейшим электрическим оборудованием, и начал экспериментировать на лягушках. Их нервы легко найти, а мышечные сокращения, которые могут продолжаться долгое время после препарации, легко увидеть. В серии экспериментов Гальвани показал, что электрический импульс исходит изнутри животного. В своей работе «De viribus electricitatis in motu musculari», опубликованной в 1792 году в Commentarii, он впервые осмелился произнести фразу «животное электричество». 4
Копия статьи попала в руки физику Алессандро Вольте – восходящей звезде науки, – и он заподозрил, что на самом деле электричество проникало в лягушку извне. Так началась многолетняя битва между двумя учёными, но никто не мог прийти к окончательному выводу о происхождении животного электричества, которое стали всё чаще называть «гальванизмом». Это продолжалось до тех пор, пока Вольта не продемонстрировал изобретение, навсегда изменившее мир. «Вольтов столб», состоящий из двух металлов, соединённых «влажным проводником» (подобным образом, по мнению учёного, зарождалось электричество в лягушке) стал первой рудиментарной батареей, создававшей электрический ток. Вольта одержал победу. Но, хотя изобретение батареи само по себе не опровергло ни одну из теорий Гальвани о животном электричестве, большинство современников были настолько поражены новым устройством и его потенциалом, что идеи Гальвани оказались забыты.
На долгие годы научное сообщество потеряло интерес к электрофизиологии, а официальные данные о животном электричестве были настолько дискредитированы (на удивление, не без помощи племянника Гальвани и его театральных экспериментов), что даже когда Леопольдо Нобили, физик из Флоренции, зарегистрировал электрическую активность нервно-мышечного препарата лягушки с помощью изобретенного им же сверхчувствительного гальванометра, он настаивал, что она как-то связана с металлами, хотя и окрестил этот эффект «corrente di rana» (ток лягушки). 1, 2
Окончательно реанимировать электрофизиологию помогли эксперименты Карло Маттеуччи и кропотливая работа Эмиля Генриха Дюбуа-Реймона, которые позволили зарегистрировать и наглядно продемонстрировать биоэлектрические явления. К концу XVIII века Дюбуа-Реймон и его коллеги успешно вернули уважение научного сообщества к биоэлектричеству. 1, 2, 3
Работа пошла полным ходом. К началу XX века учёные описали строение нервной системы, а Алан Ходжкин и Эндрю Хаксли продемонстрировали, как именно передаются нервные сигналы (с помощью ионов). Появились первая микроэлектродная техника и электрокардиографы. В течение следующих лет были обнаружены ионные каналы, и электрофизиология зашагала рука об руку с молекулярной биологией — после открытия структуры ДНК и разработки технологии секвенирования ионные каналы можно было выделять, клонировать и детально изучать их работу. 1, 3
Несмотря на то, что первые семена исследований в области электрофизиологии были посеяны ещё в XVIII веке, учёным потребовалось почти два столетия, чтобы распутать множество взаимосвязанных механизмов, лежащих в основе биологического электричества. О них мы и расскажем в этой статье.
Биоэлектричество
Трудно переоценить роль электричества в функционировании организма человека: оно имеет фундаментальное значение для нашей способности думать, чувствовать и двигаться. Прежде всего, важно отметить, что органы и ткани пронизывает вовсе не то электричество, которое заряжает телефоны или обеспечивает дома светом – в этом случае мы бы говорили о потоке отрицательно заряженных электронов.
В биологическом электричестве задействованы положительно и отрицательно заряженные ионы, такие как калий (К+), натрий (Na+), кальций (Ca2+) и хлор (Cl-). Их непрерывное движение сквозь клеточную мембрану превращает каждую из клеток в нашем теле в миниатюрную батарею с небольшим напряжением, которое называют мембранным напряжением, или мембранным потенциалом (рис. 1). Он представляет собой разницу в электрическом потенциале между внутренней и внешней частями мембраны. Когда клетка находится в состоянии покоя, мембранное напряжение называется потенциалом покоя. 5
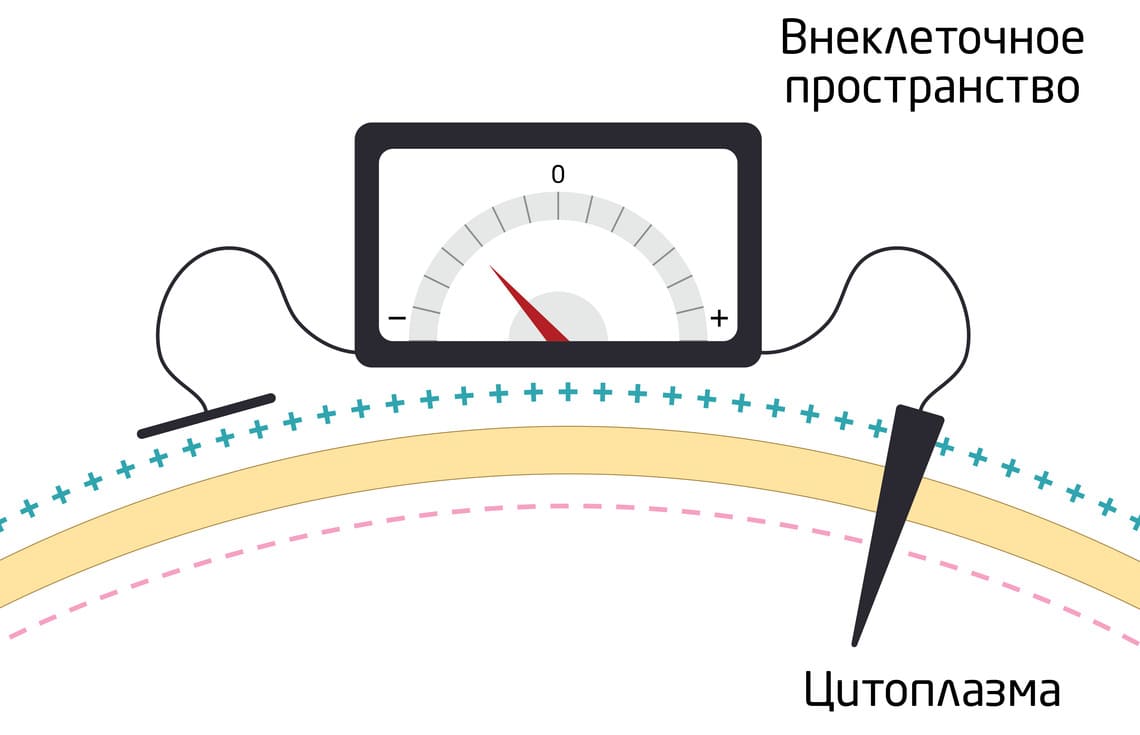
Рис. 1. Измерение мембранного потенциала с помощью микроэлектрода. В цитоплазму помещают активный электрод, во внеклеточное пространство – индифферентный электрод. Затем с помощью вольтметра измеряют разность потенциалов между внутренней и внешней частями мембраны.
5
Потенциал покоя
Потенциал покоя (ПП) представляет собой основное, относительно стабильное значение мембранного напряжения клетки в покое. Считается, что мембранное напряжение покоящейся клетки имеет отрицательное значение – обычно в диапазоне от -90 мВ до -30 мВ, – поскольку её содержимое заряжено отрицательно по отношению к внешней среде.
Чтобы поддерживать примерно один и тот же уровень напряжения, клетка неустанно работает для создания градиентов концентрации ионов, обеспечивая их непрерывное движение в клетку и из клетки. В этом ей помогают ионные насосы, основной из которых – Na+/K+-АТФаза (натрий-калиевый насос) – переносит 2 иона K+ внутрь и 3 иона Na+ наружу. В результате его работы калий имеет высокую концентрацию внутри клетки и низкую концентрацию снаружи.
Почему мы заострили внимание именно на ионах К+? Дело в том, что калий играет ведущую роль в формировании ПП. Это связано с повышенной проницаемостью мембраны для К+ по сравнению с другими ионами, которые, хотя и задействованы в данном процессе, играют гораздо меньшую роль. Таким образом, именно калий постоянно диффундирует наружу по градиенту концентрации, унося из клетки положительные заряды и оставляя на мембране нескомпенсированные отрицательные заряды. Разделение положительных и отрицательных зарядов на мембране лежит в основе формирования мембранного потенциала (рис. 2). 5
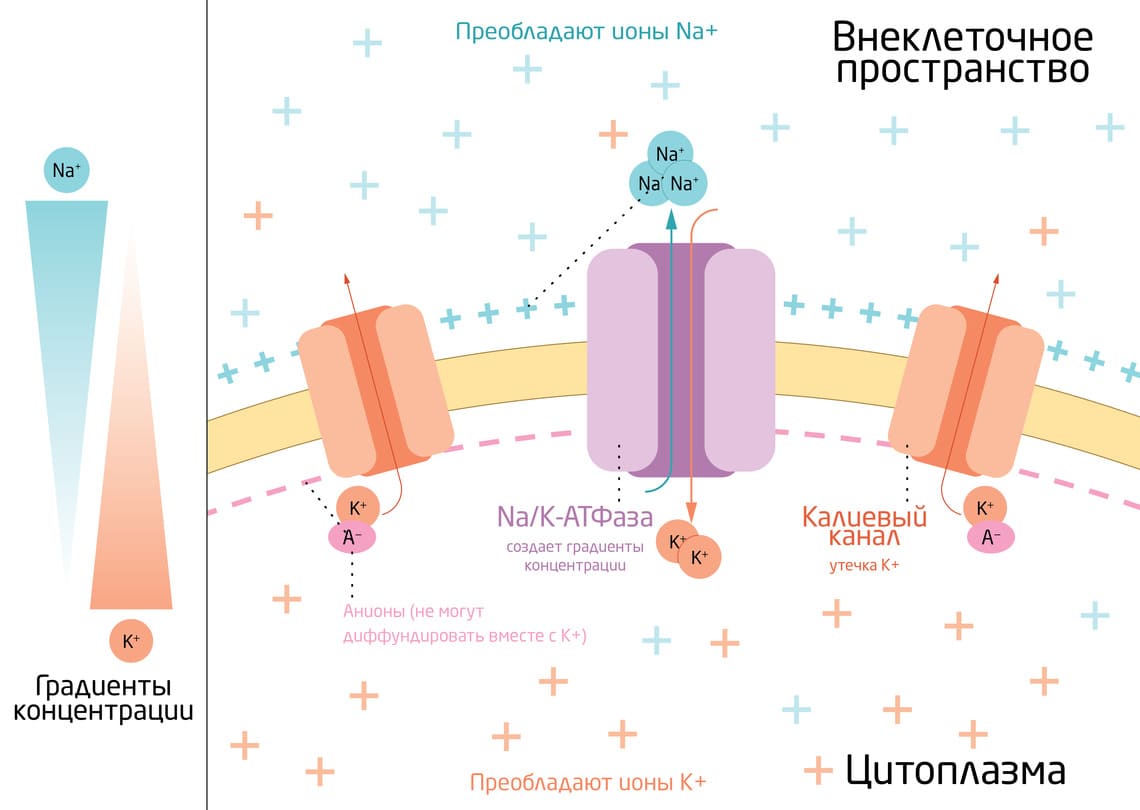
Рис. 2. Схематичное изображение формирования потенциала покоя ионами К+ и Na+.
Итак, в покое клетка постоянно поддерживает примерно один и тот же уровень мембранного напряжения — потенциал покоя. Когда на возбудимую клетку действует некий стимул, в ответ возникает потенциал действия.
Потенциал действия
Потенциал действия (ПД) — это резкое возрастание мембранного потенциала, деполяризация мембраны, распространяющаяся по клетке волной возбуждения. Na+/K+-АТФаза вносит 2 иона K+ внутрь клетки и выносит 3 иона Na+ наружу, создавая концентрационные градиенты для этих ионов. Тогда как концентрационный градиент K+ составляет основу потенциала покоя, концентрационный градиент Na+ является основой потенциала действия. Давайте рассмотрим возникновение и распространение ПД на примере нейрона.
Некий стимул, обычно сигнал в виде нейромедиатора, высвобождаемого в месте контакта нервных клеток – синапсе, вызывает локальное открытие лиганд-зависимых натриевых ионных каналов, то есть резкое повышение проницаемости мембраны для ионов Na+. Массовый вход Na+ в клетку по градиенту концентрации вносит положительный заряд внутрь, оставляя нескомпенсированные отрицательные заряды снаружи – мембранный потенциал растёт (рис. 3). Важно учитывать, что у каждой клетки есть пороговый уровень деполяризации. ПД возникнет и начнёт распространяться только если стимул будет достаточным, чтобы мембранный потенциал достиг этого порогового значения. У нейрона оно составляет около -55 мВ (рис. 4). 5
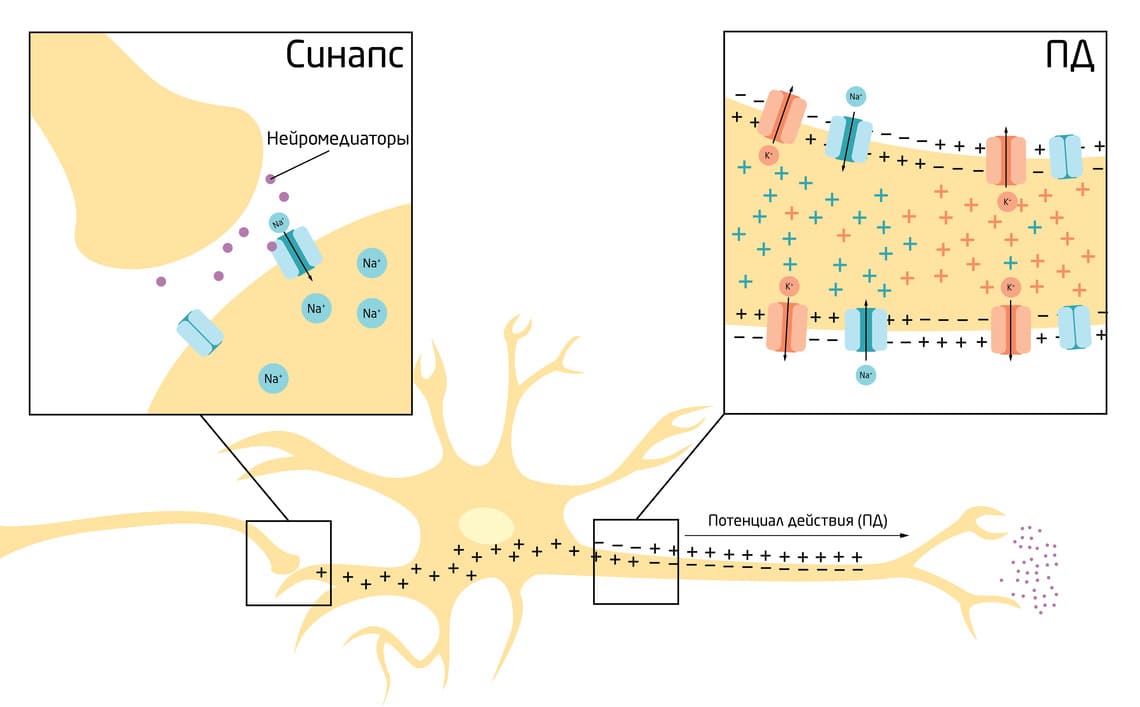
Рис. 3. Схема формирования потенциала действия в нейроне.
Превышение порогового потенциала вызывает открытие соседних потенциал-зависимых натриевых каналов. Поток ионов Na+ через них вызывает дальнейшую деполяризацию, открывая всё больше ионных каналов. Так возбуждение быстрой волной распространяется по мембране. Мембрана становится положительно заряженной внутри и отрицательно заряженной снаружи, и мембранный потенциал достигает положительного значения.
При достижении максимального значения потенциала (примерно +30-40 мВ) натриевые каналы закрываются, и Na+ больше не может проникать внутрь клетки. При этом, ионы K+ продолжают выходить из клетки, вынося положительные заряды. Происходит снижение мембранного потенциала до значения потенциала покоя – реполяризация. Она сопровождается небольшой гиперполяризацией, когда уровень мембранного потенциала ненадолго становится ниже ПП.
Когда ПД достигает конца нейрона, в синапс высвобождаются нейромедиаторы, вызывая волну возбуждения в следующем нейроне – так происходит передача нервного сигнала. Наконец, существует рефрактерный период, в течение которого клетка не может возбудиться. Это помогает сигналам не возникать слишком часто и распространяться только в одну сторону (рис. 4). 6
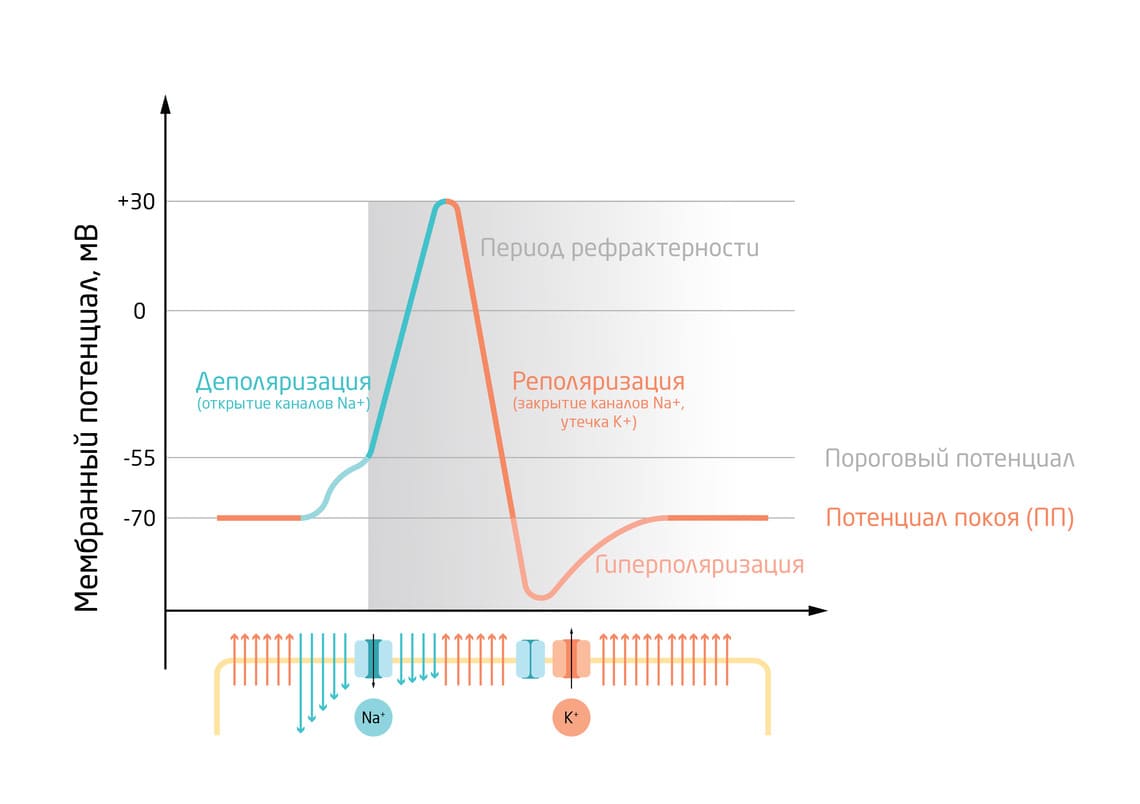
Рис. 4. Фазы потенциала действия нейрона.
Роль электричества в организме
Теперь, когда мы рассмотрели основные механизмы возникновения биоэлектричества, важно понять, какие роли оно играет в различных процессах нашего организма.
1. ЦНС.
Вне всякого сомнения, электрические сигналы играют ключевую роль в работе нервной системы. Мы уже знаем, как возникает ПД и распространяется от клетки к клетке, но как мозг различает эти сигналы между собой и анализирует поступающую в виде них информацию?
Дело в том, что потенциал действия нейронов подчиняется принципу «всё или ничего» – нервный импульс либо есть, либо нет, он всегда одной и той же максимальной амплитуды и длины вне зависимости от силы стимула. Не существует половины или трети сигнала, нервное волокно либо дает максимальный ответ, либо не дает его вообще. Как такая система используется для передачи более сложной информации? Ведь любое действие, которое мы совершаем, мысли и чувства, которые испытываем, едва ли подчиняются данному принципу.
Эту загадку распутал электрофизиолог Эдгар Дуглас Эдриан. Ответ оказался достаточно прост – частота сигналов. Нервный сигнал представляет собой серию импульсов, а их частота определяет его значение. Получается своеобразный биоэлектрический код.
Интересно, что амплитуда рецепторных потенциалов, которая возникает при активации сенсорного рецептора, наоборот, меняется – чем сильнее раздражитель, тем выше амплитуда и частота следующих за этим нервных импульсов. Так мы понимаем нарастание и убывание ощущений, которые в итоге представляют собой лишь нарастание и убывание частоты импульсов. 1, 6
Так мы и живём: непрекращающаяся симфония сигналов, перетекающих от рецепторов к мозгу и обратно, проходящих через сложную сеть нейронов, в конечном итоге достигая и мышц.
2. Скелетные мышцы.
ПД составляют основу мышечного сокращения. Генерация потенциалов действия в клетках скелетных мышц сходна с таковой в нейронах, но с небольшими отличиями в скорости и продолжительности. Потенциал покоя скелетных мышц ниже – около -90 мВ.
Все начинается с сигнала от нервной системы, который доходит до нервно-мышечного синапса. Нейрон выпускает в синапс нейромедиаторы, которые, как и в случае с двумя нейронами, вызывают локальную деполяризацию на мембране мышечной клетки, а затем возникновение и распространение ПД.
Тогда как в нервах ПД служит для передачи сигналов из одной области к другой, в скелетных мышцах предполагается распространение возбуждения по всей ткани, что приводит к повышению уровня внутриклеточного Са2+ за счёт открытия потенциал-зависимых кальциевых каналов. Кальций в свою очередь приводит к мышечному сокращению. 5
3. Сердце.
Потенциал действия клеток сердца отличается от потенциалов действия других типов электрически возбудимых клеток и, кроме того, различается даже в пределах самого сердца: в ПД сократительных кардиомиоцитов – клеток сердца – есть фаза плато, появляющаяся за счёт потока ионов Са2+ внутрь клетки. Эта фаза важна для регуляции ритма сердца и предотвращения аритмии.
В отличие от скелетных мышц ПД в сердце не инициируется нервной активностью. Вместо этого он возникает из группы специализированных клеток, известных как пейсмейкеры. Они могут автоматически, то есть самопроизвольно, генерировать потенциал действия, который затем распространяется по сердцу и вызывает его сокращение. В них нет быстрых натриевых каналов, как у нейронов, а деполяризация вызвана медленным притоком ионов Na+ и Ca2+. Пейсмейкеры составляют проводящую систему сердца, задавая сердечный ритм. Похожим образом они также контролируют сокращения в желудочно-кишечном тракте.
Ещё одна отличительная черта клеток сердечной мышцы заключается в том, что они связаны друг с другом нексусами – межклеточными контактами, которые позволяют потенциалу действия передаваться от одной клетки к другой за счёт прямого переноса ионов между клетками. Передача электрического сигнала через нексусы гораздо быстрее, чем через синапсы, благодаря мгновенной передаче ионов. Поэтому все клетки предсердий и желудочков могут сокращаться практически одновременно.
Данные особенности обеспечивают точную, ритмичную и синхронизированную работу сердца. 5
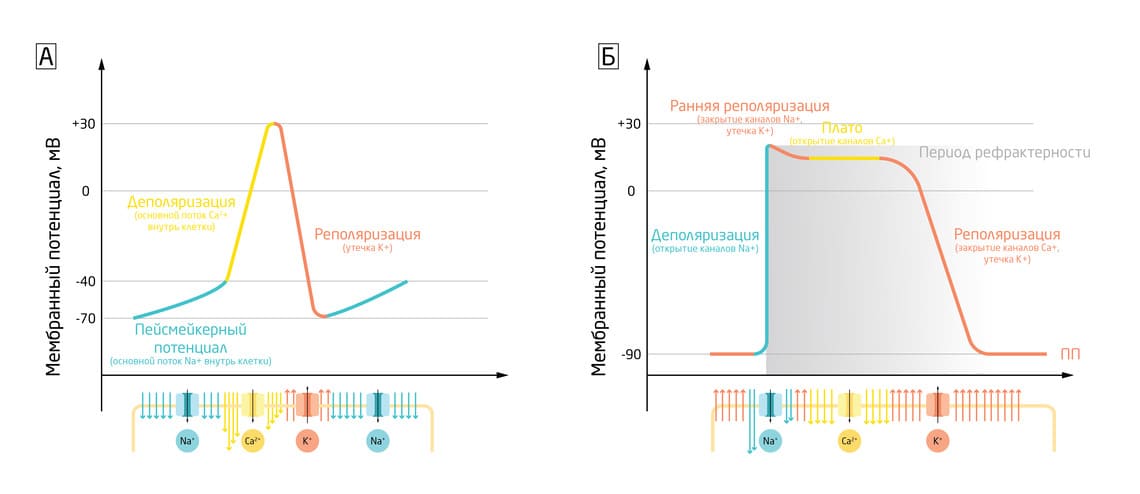
Рис. 5. Фазы потенциалов действия пейсмейкеров (А) и сократительных кардиомиоцитов (Б).
Что ещё контролирует биоэлектричество?
Феномен биоэлектричества чаще всего обсуждается как явление, которое способствует распространению потенциалов действия в мышцах и нервах. Однако по мере того, как исследования ионных каналов вышли за пределы этих тканей, стало очевидно, что все клетки, а не только возбудимые нейроны и мышцы, генерируют и получают устойчивые биоэлектрические сигналы. Ионные каналы присутствуют повсеместно – в человеческих клетках, клетках животных, растений и микроорганизмов. Их активность определяет мембранное напряжение клетки и тем самым её поведение – нельзя говорить о живой системе, не учитывая её электрическую составляющую.
Биоэлектричество – мощный, но пока малоизученный регулятор клеточных процессов. Новые данные показывают, что биоэлектрические явления являются ключевыми регуляторами пролиферации и дифференцировки клеток, циркадного ритма, клеточного цикла, эмбриогенеза, иммунного ответа, регенерации и т.д. Развитие злокачественных опухолей, то есть нарушение в клеточном цикле и пролиферации, также тесно связано с биоэлектрическими процессами, что потенциально открывает новые методы борьбы с раковыми клетками. 1, 6, 7
Один из биоэлектрических механизмов, который задействован в большом количестве разных на первый взгляд процессов – электротаксис, или гальванотаксис, то есть движение клеток под действием электрических полей. Всё больше данных свидетельствует о существенном влиянии этого феномена на ряд важных процессов в организме, требующих направленной миграции клеток (эмбриогенез, морфогенез, регенерация). В некоторых случаях он имеет даже большее влияние, чем хемотаксис.
Сигнальные пути, участвующие в феномене электротаксиса, до сих пор полностью не изучены. Некоторые предположения связаны с ассиметричным расположением клеточных компонентов, участвующих в создании ионных токов, их миграцией под действием электрического стимула и протонными насосами, обеспечивающими полярность клетки. 1, 8
Электрический угорь
И напоследок то, что, скорее всего, первым приходит в голову при слове «биоэлектричество» – электрический угорь, который, как считается, вдохновил изобретение батареи Алессандро Вольтой. У электрических рыб (угорь лишь одна из многих рыб, способных генерировать и воспринимать электрических заряды) есть специальные электрические органы, состоящие из особых клеток под названием электроциты. Способность генерировать электрические заряды – уникальный процесс, в котором участвуют уже знакомые нам ионы.
Когда электрический угорь чувствует приближение добычи или угрозы, мозг посылает сигнал через нервную систему к электроцитам. Нервные волокна подходят к каждому электроциту, но только с одной стороны. Поступление сигнала, как мы уже знаем, вызывает поток положительно заряженных ионов Na+ внутрь клетки. Это вызывает деполяризацию мембраны, при которой клетка поляризуется, становясь положительно заряженной со стороны контакта и отрицательно заряженной с другой. Появляется напряжение и электрический ток. Напряжение, создаваемое каждой клеткой, невелико, однако электроциты расположены в стопках из тысяч клеток, поэтому угорь может произвести электрический разряд в сотни вольт с силой тока до 1 ампера (рис.7). 9 Описанный в 2019 году новый вид электрического угря Electrophorus voltai был назван в честь Вольты и является самым сильным производителем биоэлектричества в природе на сегодняшний день – его максимальное зарегистрированное напряжение составляет 860 вольт.
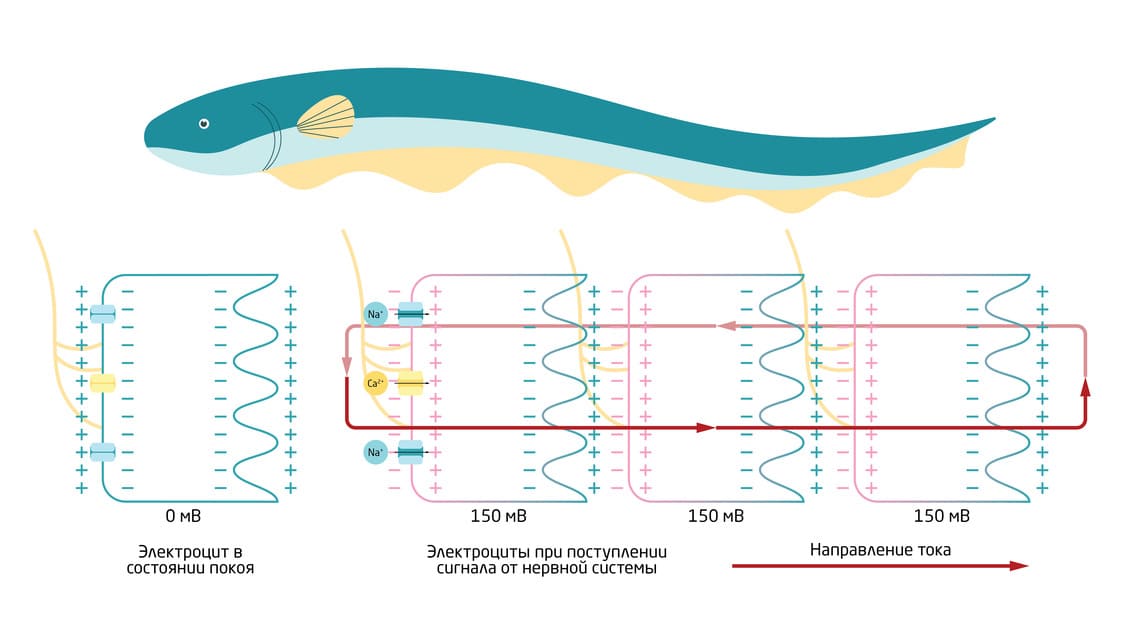
Рис. 7. Схема работы электроцитов.
За последние годы стало ясно, что электричество играет гораздо более глубокую роль в биологических функциях, чем просто возбуждение потенциалов действия. Изучение биоэлектричества способствовало формированию более широкого взгляда на многие вещи, касающиеся нашего развития. Хотя эта область науки всё еще находится на ранней стадии развития, теперь у нас есть возможности, чтобы раскрыть секреты и потенциал биоэлектричества.
Литература
1. Adee S. We Are Electric: The New Science of Our Body’s Electrome. Canongate Books, 2023.
2. Piccolino M., Bresadola M. Shocking frogs: Galvani, Volta, and the electric origins of neuroscience. Oxford University Press, 2013.
3. Тетенев Ф. Ф., Степанищева А. В. Истоки электрофизиологии и электрокардиографии. Бюллетень сибирской медицины, 2014.
4. Galvani L. et al. De viribus electricitatis in motu musculari: commentarius cum Joannis Aldini dissertatione et notis: accesserunt epistolae ad animalis electricitatis theoriam pertinentes . Apud Societatem Typographicam, 1792.
5. Агаджанян Н. А. и др. Физиология человека. 2002.
6. Abdul Kadir L., Stacey M., Barrett-Jolley R. Emerging roles of the membrane potential: action beyond the action potential. Frontiers in physiology, 2018.
7. Adams D.S. et al. The Bioelectricity Revolution: A Discussion Among the Founding Associate Editors. Bioelectricity, 2019.
8. Moarefian M. et al. Electrotaxis-on-chip to quantify neutrophil migration towards electrochemical gradients. Frontiers in Immunology, 2021.
9. Gotter A.L., Kaetzel M.A., Dedman J.R. Electrocytes of Electric Fish. Academic Press, 2001.




.jpg)