Медиатека
Система CRISPR/Cas – от идеи к практике
Оглавление:
•
Принципы работы системы редактирования CRISPR/Cas9
•
Есть ли альтернативы?
•
Области применения
За последние 10 лет уникальный инструмент редактирования генома CRISPR/Cas9 произвел научную революцию в биологии и медицине как быстрый, дешевый и точный метод, обладающий огромным потенциалом.
Нередко учёные подглядывают за природой, а потом используют находки в своих целях. Так произошло и с системой СRISPR/Cas. Ее история связана с открытием и изучением адаптивного иммунитета прокариот, основанном на использовании коротких РНК, закодированных в особых последовательностях генома (СRISPR-локусах), которые направляют нуклеазу Cas для создания сайт-специфичных надрезов в чужеродной ДНК. При попадании в бактерию вирусных частиц (бактериофагов) с помощью системы СRISPR/Cas происходит разрезание вирусной ДНК, небольшие кусочки которой сохраняются в геноме бактерии в специальных областях – спейсерах – и предназначены для распознавания и защиты при повторном инфицировании.
История изучения этого процесса берет своё начало в Японии в 1987 году. Учёные университета Осака впервые заметили 1 необычный паттерн ДНК в геноме E. coli, который имел 5 коротких идентичных повторов, разделенных уникальными спейсерами. В то время ученые не могли предсказать биологические функции этих элементов из-за недостатка информации. В 1993 году испанский учёный Франсиско Мохика обратил более пристальное внимание на странные палиндромные последовательности в геноме архей и даже дал им название - SRSR (Short Regularly Spaced Repeats)2,3. Дальнейшие исследования показали, что такие паттерны характерны для большинства архей и многих видов бактерий. Впоследствии их переименовали в CRISPR (Сlustered Regularly Interspaced Short Palindromic) – кластерно расположенные короткие палиндромные повторы.
В 2002 году было замечено4, что СRISPR-последовательностям всегда сопутствуют белок-кодирующие гены, названные cas (акроним от CRISPR-ASsociated), функция которых оставалась пока неясной.
К 2005 году было накоплено достаточно данных, свидетельствующих о соответствии спейсеров фрагментам ДНК из геномов бактериофагов, и сразу 3 научные группы опубликовали сходные результаты, выдвинув предположение о связи CRISPR-локусов с механизмом антивирусной защиты бактерий5. Позднее это предположение подтвердили экспериментально.
В 2007 году группа микробиологов во главе с Филиппом Хорватом инфицировала бактериофагами важную промышленную культуру Streptococcus thermophilus, которую используют для ферментации молока6. Часть этих бактерий выжила и получила устойчивость к вирусам. Оказалось, что выжившие бактерии коллекционировали фрагменты генома вирусов в спейсерных последовательностях и использовали их для последующей защиты. При удалении спейсеров некогда устойчивые штаммы теряли способность защищаться от инфицирования. Эта же группа ученых изучала гены cas и показала ключевую роль белка Cas9 в расщеплении чужеродной ДНК.7
Дальнейшие исследования раскрыли подробности функционирования элементов CRISPR/Cas в иммунной системе прокариот, а несколько научных групп придумали, как использовать их для редактирования ДНК других организмов.
В 2012 году коллаборация ученых, включая Дженнифер Дудну и Эммануэль Шарпантье8, получивших в 2020 году Нобелевскую премию, а также группа Виргиниуса Шикшниса9 реконструировали систему СRISPR/Cas и доказали возможность ее использования для направленного разрезания ДНК in vitro. Следующим шагом стало исследование возможностей системы на живых клетках. Спустя 3 три года независимые лаборатории опубликовали статьи с результатами редактирования геномов млекопитающих, включая человеческий. С этого момента количество публикаций о редактировании геномов разных организмов (дрожжей, нематод, плодовых мушек, мышей, обезьян и др.) с помощью CRISPR/Cas молниеносно росло, а сама система зарекомендовала себя как уникальную технологию, позволяющую исследователям быстро и просто изменять последовательности ДНК6,10.
Принципы работы системы редактирования CRISPR/Cas9
На сегодняшний день изучены многочисленные вариации природных систем CRISPR/Cas, а модификация одной из них (из Streptococcus pyogenes) привела к созданию технологии редактирования геномов. Она известна как СRISPR/Cas9 и широко используется учеными со всего мира.
Система состоит из двух ключевых молекул – эндонуклеазы Cas9, которая осуществляет двухцепочечный разрез ДНК, и молекулы гидовой РНК (гРНК), которая направляет комплекс с Cas9 в необходимый участок генома. гРНК состоит из двух частей: константной, которая образует каркас для связывания Cas9, и части из 20 нуклеотидов, комплементарных последовательности целевой ДНК (протоспейсеру). Сайт-мишень в ДНК также включает две части: протоспейсер и примыкающий к нему короткий, но очень важный PAM-мотив (Protospacer-Adjacent Motif), без которого невозможно разрезание ДНК.
После объединения гРНК с Cas9 их активный комплекс находит в геноме целевой участок ДНК, связывается с последовательностью PAM и раскручивает двухцепочечную спираль, а комплементарная последовательность в гРНК связывается с одной из цепей. Если происходит эффективное связывание, эндонуклеазные домены Cas9 расщепляют обе цепи ДНК на 3-4 основания выше PAM-мотива.
После того, как происходит разрезание ДНК, запускается система репарации клетки. Далее есть два варианта развития событий – может произойти негомологичное соединение концов (при этом образуются вставки или делеции неопределенного числа нуклеотидов, что может привести к нарушениям в структуре и работе функциональных элементов генома) или гомологичная рекомбинация, в ходе которой можно осуществить вставку необходимой исследователю последовательности ДНК.9,11
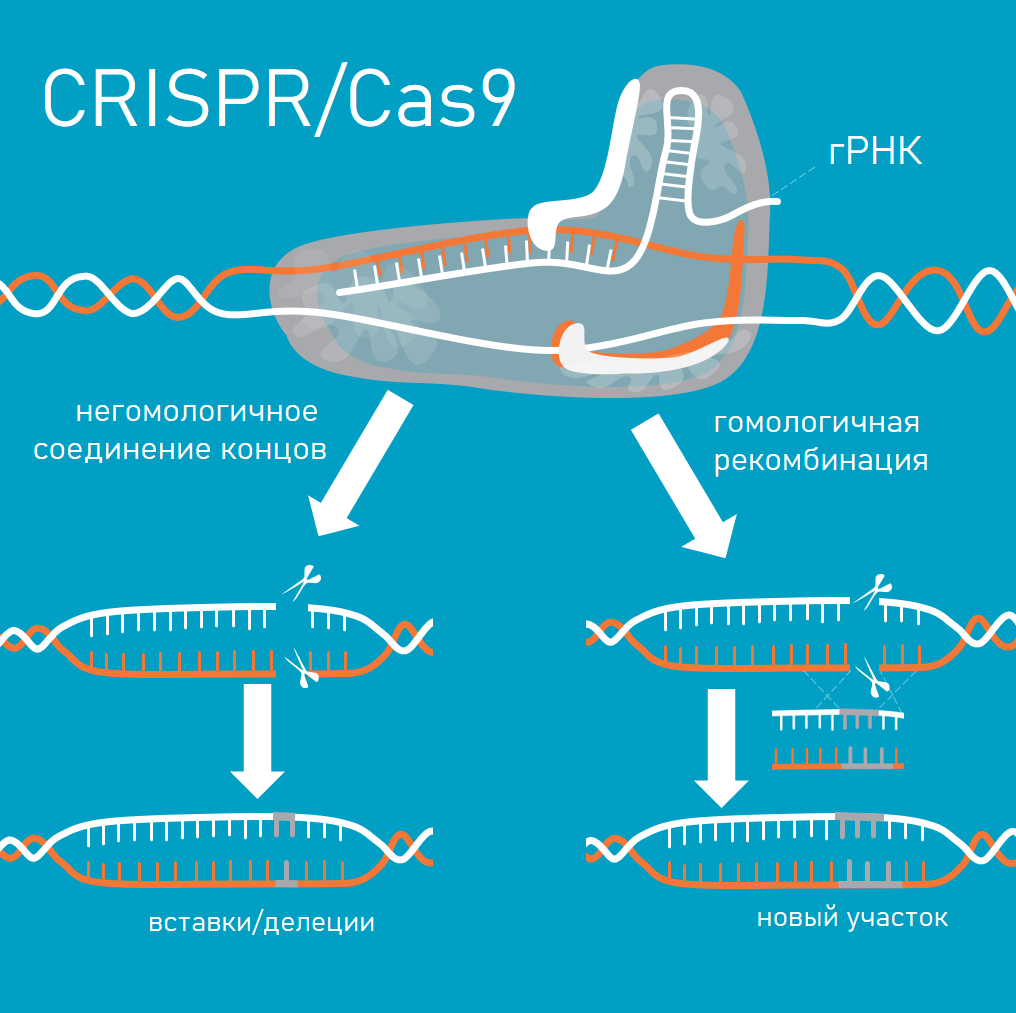
Как и любой метод, технология CRISPR/Cas9 не лишена недостатков, основной из которых – вероятность нецелевого связывания в разных местах генома. Однако современные модификации метода позволяют свести эту вероятность к минимуму. Например, использование двух белков Cas9, каждый из которых делает одноцепочечный разрыв, и т.д.
Есть ли альтернативы?
До появления методов редактирования генома для создания мутаций использовались мутагены (этилметансульфонат, ультрафиолет, радиация), однако это приводило к случайным ненаправленным мутациям12. Достижения генной инженерии позволили создать гораздо более точные способы внесения направленных изменений в геномы живых организмов. Наиболее известные из них, помимо CRISPR/Cas9, это использование нуклеаз ZFN и TALEN. Такие подходы медленные, трудозатратные, очень дорогие и, кроме того, сложные в применении, так как для каждой новой мутации необходимо конструировать и экспрессировать новый измененный белок13. Несмотря на это, данные методы позволили сильно расширить понимание геномного редактирования и получить значимое количество результатов, а TALEN в простейшем случае обладает большей точностью, чем СRISPR/Cas9. Тем не менее, последний фактически вытеснил другие подходы, так как намного проще в использовании, универсален и может быть адаптирован для большинства живых систем14.
Области применения
Технология СRISPR/Cas9 очень быстро внедрилась в самые разные области исследований и сейчас применяется для множества целей – нокаута и редактирования генов на уровне клеток и целых организмов15, регуляции транскрипции генов, редактирования эпигенома, высокопроизводительного геномного скрининга и многих других.16,17,18,19
Пожалуй, наибольший интерес вызывает использование СRISPR/Cas9 в клинических и терапевтических целях. Технология произвела революцию в этой области, позволив точно имитировать различные модификации ДНК (от точечных мутаций до хромосомных транслокаций) на клеточных линиях и животных, создавая модели генетических заболеваний.
Возможности СRISPR/Cas9 позволяют применять ее в генной терапии для нокаутирования (выключения) или редактирования «сломанных» генов. Это может избавить от многих заболеваний, имеющих генетическую компоненту, например, рака. В 2016 году китайский пациент стал первым человеком, получившим инъекцию клеток, модифицированных системой СRISPR/Cas920. В иммунных клетках крови пациента был инактивирован ген, кодирующий необходимые для деления раковых клеток белок, что привело к замедлению роста агрессивной опухоли.
Использование СRISPR/Cas9 уже показало свою эффективность в терапии таких генетических заболеваний, как бета-талассемия и серповидноклеточная анемия – сейчас эти протоколы проходят клинические испытания.21,22,23
На клеточных и животных моделях СRISPR/Cas9 применили для исправления генетических дефектов, лежащих в основе таких заболеваний, как нейропатия Лебера24, миодистрофия Дюшена25, муковисцидоз26, катаракта и других27. Также система CRISPR/Cas9 оказалась эффективной в борьбе с бактериальными и вирусными инфекциями (включая ВИЧ-128, гепатит Б29 и др.) и паразитарными заболеваниями30.
Большинство манипуляций можно проводить на соматических клетках, однако редактирование генома на зародышевых клетках вызывает ряд этических вопросов и на данный момент незаконно в большинстве стран. Тем не менее, в 2018 году китайский ученый Цзянькуй Хэ заявил о рождении первых в мире детей, геномы которых были отредактированы, в обход запретов, на стадии эмбрионов. Эта новость всполошила общественность, вызвав новую волну бурных обсуждений.
Редактирование организмов с помощью СRISPR/Cas9 активно внедряется в биотехнологии и сельское хозяйство. Компании и лаборатории по всему миру работают над созданием растений, более устойчивых к заболеваниям и вредителям, содержащих больше полезных веществ, а также продуктов, не вызывающих аллергических реакций31.
СRISPR/Cas9 позволяет оптимизировать производство малых молекул и белков в промышленности. Например, компания Synthetic Genomics смогла значительно повысить выход липидов, продуцируемых водорослями, тем самым увеличив объем биодизеля, который можно из них получить32.
Самое необычное применение СRISPR/Cas9 – воссоздание вымерших видов, включая странствующих голубей и мамонтов. Такие эксперименты уже проводятся в Гарварде.33
Несмотря на то, что в области геномного редактирования остаётся много неизвестного, СRISPR/Cas9 подарил учёным возможность быстро и просто изменять организмы для нужд человечества и стал ключиком к решению многих важных вопросов.
Литература
1. Ishino Y. et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isoenzyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology, 1987.
2. Mojica F.J. et al. Transcription at different salinities of Haloferax mediterranei sequences adjacent to partially modified PstI sites. Molecular Microbiology, 1993.
3. Mojica F.J. et al. Long stretches of short tandem repeats are present in the largest replicons of the Archaea Haloferax mediterranei and Haloferax volcanii and could be involved in replicon partitioning. Molecular Microbiology, 1995.
4. Jansen R. et al. Identification of genes that are associated with DNA repeats in prokaryotes. Molecular Microbiology, 2002.
5. Lander E.S. The Heroes of CRISPR. Cell, 2016.
6. Barrangou R. et al. CRISPR Provides Against Viruses in Prokaryotes. Science, 2007.
7. Garneau J.E. et al. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature, 2010.
8. Jinek M. et al. A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science, 2012.
9. Gasiunas G. et al. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences, 2012.
10. Barrangou R., Doudna J.A. Applications of CRISPR technologies in research and beyond. Nature Biotechnology, 2016.
11. Lanik E. et al. Various Aspects of a Gene Editing System-CRISPR-Cas9. International Journal of Molecular Sciences, 2020.
12. Hsiao Y.M., Ko J.L. Determination of destruxins, cyclic peptide toxins, produced by different strains of Metarhizium anisopliae and their mutants induced by ethyl methane sulfonate and ultraviolet using HPLC method. Toxicon, 2001.
13. Wei C. et al. TALEN or Cas9 - Rapid, Efficient and Specific Choices for Genome Modifications. Journal of Genetics and Genomics, 2013.
14. Gaj T. et al. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology, 2013.
15. Shalem O. et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science, 2014.
16. Xie N. Novel Epigenetic Techniques Provided by the CRISPR/Cas9 System. Stem Cells International, 2018.
17. Ford K. et al. Functional Genomics via CRISPR-Cas. Journal of Molecular Biology, 2019.
18. Kantor A. et al. CRISPR-Cas9 DNA Base-Editing and Prime-Editing. International Journal of Molecular Sciences, 2020.
19. Gilbert L.A. et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell, 2013.
20. Cyranovsky D. CRISPR gene editing tested in a person for the first time. Nature, 2016.
21. Frangoul H. et al. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. The New England Journal of Medicine, 2021.
22. A Safety and Efficacy Study Evaluating CTX001 in Subjects With Severe Sickle Cell Disease. U.S. National Library of Medicine, 2022.
23. iHSCs With the Gene Correction of HBB Intervent Subjests With β-thalassemia Mutations. U.S. National Library of Medicine, 2018.
24. Meader M.L. et al. Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10. Nature Medicine, 2019.
25. Nelson C.E. et al. In vivo genome editing improves muscle function in a mouse model of Duchenne muscular dystrophy. Science, 2016.
26. Fan Z. et al. A sheep model of cystic fibrosis generated by CRISPR/Cas9 disruption of the CFTR gene. JCI Insight, 2018.
27. Wu S. et al. Advances in CRISPR/Cas-based Gene Therapy in Human Genetic Diseases. Theranostics, 2020.
28. Yin C. et al. In Vivo Excision of HIV-1 Provirus by saCas9 and Multiplex Single-Guide RNAs in Animal Models. Molecular Therapy, 2017.
29. Yang Y., Yang H. Recent Progress and Future Prospective in HBV Cure by CRISPR/Cas. Viruses, 2021.
30. Bryant J.M. et al. CRISPR in Parasitology: Not Exactly Cut and Dried!Trends in Parasitology, 2019.
31. Brackett N.F. et al. New Frontiers: Precise Editing of Allergen Genes Using CRISPR. Frontiers in Allergy, 2022.
32. Mascarelli A.L. Gold rush for algae. Nature, 2009.
33. Bringing the Wooly Mammoth back to life with CRISPR/CAS9. Splice, 2017.




.jpg)