Медиатека
Выделение микроРНК
Оглавление:
•
Анализ микроРНК: особые указания
1. Источники микроРНК
2. Концентрация микроРНК, определение фона и контроль качества
3. Нежелательные компоненты
4. Контрольные РНК-шпильки
5. РНК-носитель
6. Рекомендации по обработке и хранению РНК
7. Методы выделения микроРНК
•
Контроль качества
1. Хранение очищенной РНК
2. Целостность РНК
3. Количественное определение РНК из биожидкостей и стандартизация объёмов
4. Загрязнение ДНК
5. Оценка качества РНК с помощью ПЦР
6. Основные параметры контроля качества
•
Базовый контроль качества: стандарты для сыворотки и плазмы крови человека
•
Расширенный контроль качества: сложные образцы биожидкостей
2. Концентрация микроРНК, определение фона и контроль качества
3. Нежелательные компоненты
4. Контрольные РНК-шпильки
5. РНК-носитель
6. Рекомендации по обработке и хранению РНК
7. Методы выделения микроРНК
2. Целостность РНК
3. Количественное определение РНК из биожидкостей и стандартизация объёмов
4. Загрязнение ДНК
5. Оценка качества РНК с помощью ПЦР
6. Основные параметры контроля качества
Интерес к малым РНК (<200 нуклеотидов), таким как микроРНК, возрос в последние годы, поскольку стала более понятна их регуляторная роль. Для успешного профилирования экспрессии микроРНК решающее значение имеет подготовка общей РНК. В частности, необходимо предотвращать попадание в образцы РНКазы, чтобы РНК не деградировала.
Анализ микроРНК: особые указания
1. Источники микроРНК
Основная масса микроРНК в цельной крови находится внутри клеток, однако особый интерес для изучения биомаркеров представляет бесклеточная популяция. Такие микроРНК высвобождаются клетками разных типов практически во всех органах. К высвобождению микроРНК приводят, например, секреция внеклеточных везикул и гибель клеток. Оба этих процесса важны с точки зрения обнаружения биомаркеров. Бесклеточные малые РНК защищены от деградации с помощью либо ВВ (внеклеточных везикул), либо белковых комплексов. При создании профилей биомаркеров может быть полезно различать эти группы.
2. Концентрация микроРНК, определение фона и контроль качества
Работа с бесклеточными биожидкостями может осложняться большими различиями в концентрации микроРНК в разных образцах. У здоровых людей она обычно низкая, однако у больных людей или тех, кто подвергся действию лекарств и ядов, уровень микроРНК может быть значительно повышен.
Важно убедиться, что измеряемые сигналы выше любых фоновых, поэтому при определении микроРНК необходимо использовать отрицательный контроль, например, воду.
Поскольку биожидкости содержат крайне мало РНК, обычный контроль качества с помощью капиллярных измерений ОD для них невозможен – следует использовать другие методы (подробнее – в разделе
«Контроль качества»).
2. Нежелательные компоненты
В биожидкостях содержатся ингибиторы полимеразы и обратной транскриптазы, способные подавлять реакции ПЦР с обратной транскрипцией (ОТ-ПЦР), а также мешать подготовке библиотек для секвенирования. Поэтому перенос ингибиторов в образцы необходимо сводить к минимуму.
3. Контрольные РНК-шпильки
Использование даже лучших стандартных процедур выделения РНК не гарантирует ни отсутствия ингибиторов, ни воспроизводимости результатов. Для оценки эффективности выделения РНК, синтеза кДНК и амплификации с помощью ПЦР к образцу может быть добавлено известное количество РНК-шпилек. Кроме того, добавление РНК-шпилек помогает выявить присутствие нуклеаз. Контрольные РНК-шпильки поставляются, например, в наборе RNA Spike-in Kit, for RT.
РНК-шпильки также полезны для мониторинга экспериментов по секвенированию микроРНК. Панель QIAseq® miRNA Library QC PCR Panel and Assays содержит 52 шпильки, позволяющие оценить как качество образца РНК до подготовки библиотеки микроРНК для NGS, так и производительность NGS после секвенирования (подробнее – в разделе «Контрольные шпильки для NGS»).
Однако для нормализации образцов синтетические РНК-шпильки использовать нельзя. Следует брать стабильно экспрессируемые эндогенные референсные гены или, если это возможно, среднее значение всех экспрессируемых микроРНК (подробнее –в разделе «Нормализация»).
4. РНК-носитель
Во многих наборах QIAGEN и PreAnalytiX для выделения РНК использование РНК-носителей необязательно, но есть свидетельства, что использование РНК-носителя приводит к повышению воспроизводимости. Например, в качестве носителя можно брать РНК бактериофага MS2 (Roche Applied Science, кат. № 10165948001). В образцы, предназначенные для NGS, РНК-носитель добавлять не следует.
5. Рекомендации по обработке и хранению РНК
Следующие меры предосторожности помогают предотвратить загрязнение РНК и деградацию образца РНК и реагентов:
- использование одноразовых перчаток, работа в среде, свободной от нуклеаз;
- закупоривание пробирок и кратковременное их центрифугирование перед открытием;
- избегание повторных циклов замораживания-размораживания;
- хранение РНК при соответствующей температуре (раздел «Хранение очищенной РНК);
- использование пипеток с барьерным фильтром и пластиковой посуды, не содержащей нуклеиновых кислот.
6. Методы выделения микроРНК
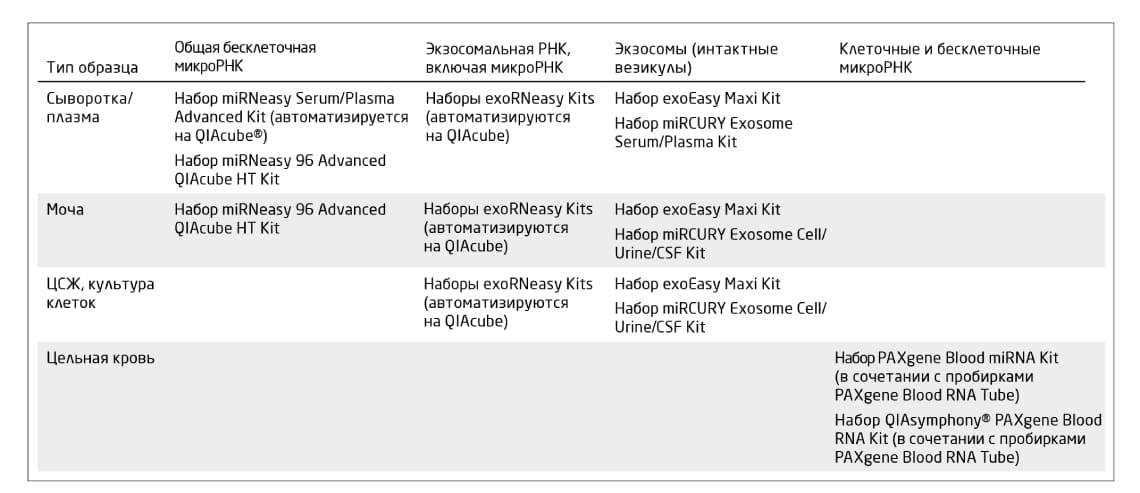
QIAGEN и PreAnalytiX предлагают наборы, оптимизированные для выделения микроРНК из экзосом и биожидкостей. Важно выбрать метод, который сведёт к минимуму перенос в образец ингибиторов. В Таблице 1 показаны наборы, подходящие для такой цели.
Таблица 1. Рекомендуемые наборы для выделения РНК из биологических жидкостей. *Выделены все клеточные и бесклеточные микроРНК, хотя избыток клеточных микроРНК бесклеточные анализировать не позволяет.
Контроль качества
1. Хранение очищенной РНК
Храните очищенную РНК при температуре от –15°C до –90°C в воде, не содержащей РНКаз. В этих условиях деградация РНК не обнаруживается через 1 год.
2. Целостность РНК
Целостность РНК, выделенной из цельной крови, анализируют с помощью стандартного гелевого или капиллярного электрофореза. По сравнению с РНК, полученной из клеточных культур, показатели целостности часто ниже из-за относительно высокой доли малых РНК, принимаемых алгоритмами за продукты деградации 1. Бесклеточная РНК из сыворотки или плазмы крови в основном содержит малые РНК или фрагментированные РНК размером <100 нуклеотидов. Целостность бесклеточных РНК нельзя проанализировать стандартными методами. Анализ с использованием чипа Small RNA Chip не различает микроРНК, а, поскольку рибосомальные полосы для бесклеточных микроРНК не видны, значения RIN недействительны. Появление полос рибосомальной РНК обычно указывает на загрязнение образцов клетками или дебрисом.
3. Количественное определение РНК из биожидкостей и стандартизация объёмов
Ввиду низкой концентрации РНК в биожидкостях, концентрацию РНК в элюате нельзя надёжно измериить спектрофотометрически. Присутствие загрязняющих веществ, поглощающих при длине волны около 260 нм, может ещё сильнее исказить результаты. Флуорометрический метод также не отличается надёжностью для коротких фрагментов НК. Если необходимо точное количественное определение, используйте количественную ПЦР, направленную на интересующие вас (микро)РНК. Стандартизацию образцов рекомендуется проводить по их объёму, а не по количеству РНК.
4. Загрязнение ДНК
Ни один из имеющихся методов очистки не гарантирует, что РНК полностью свободна от ДНК, даже если последняя не определяется аналитически. Хотя наборы miRNeasy и PAXgene miRNA удаляют большую часть клеточной ДНК, следовые количества могут сохраниться. Однако в отличие от цельной крови бесклеточные жидкости организма содержат очень мало ДНК. Кроме того, ПЦР-анализы QIAGEN, определяющие зрелые микроРНК, не амплифицируют ДНК.
5. Оценка качества РНК с помощью ПЦР
РНК можно исследовать с помощью комбинации синтетических РНК-шпилек и определения некоторых эндогенных микроРНК, что позволяет выявить некачественные или потенциально выпадающие образцы до проведения дальнейшего анализа. При работе с другими образцами биожидкостей необходимо определить эндогенные микроРНК, соответствующие данному типу образцов, путём сравнения с литературными значениями, либо путём проведения пилотного исследования с использованием панели miRNome.
Компания QIAGEN разработала набор синтетических РНК-шпилек и эндогенных микроРНК для контроля качества образцов методом количественной ПЦР. В набор RNA Spike-In Kit для ОТ входят шпильки для контроля эффективности выделения РНК, синтеза кДНК и амплификации. Набор miRCURY LNA RT Kit включает шпильки для контроля синтеза кДНК (Таблица 2).
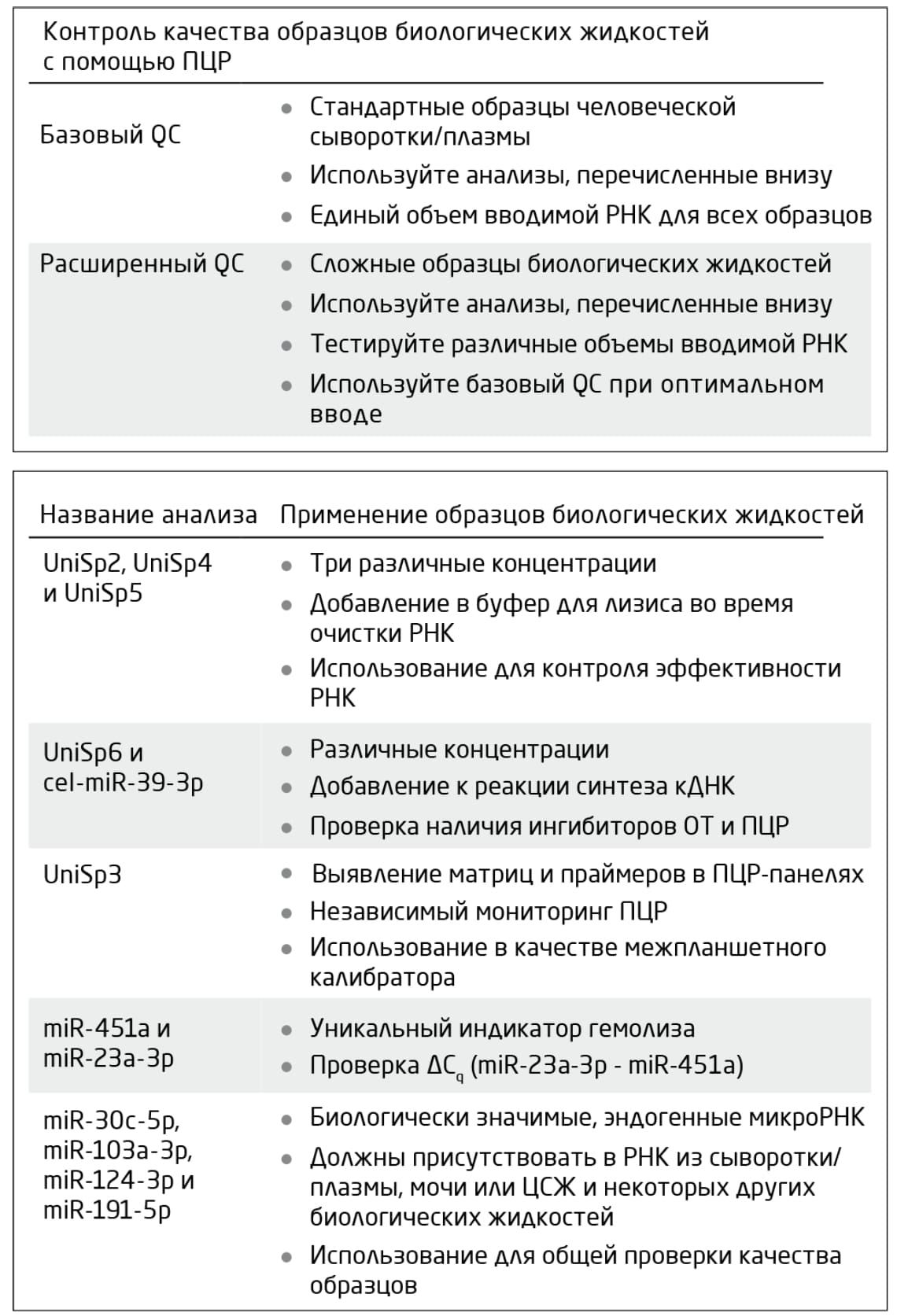
Таблица 2. Обзор проб в панели miRCURY LNA miRNA QC PCR Panel и их применение для базового и расширенного контроля качества. Пробы используются для контроля эффективности выделения РНК и её выхода, производительности реакций синтеза кДНК и ПЦР, а также общего качества образца. Пробы доступны в составе набора QC PCR Panel или по отдельности. Шпильки UniSp2, UniSp4, UniSp5 и cel-miR-39-3p входят в состав набора RNA Spike-In Kit. UniSp6 входит в набор miRCURY LNA RT Kit. UniSp3 доступен только на панелях. Более подробная информация – в соответствующих руководствах к наборам.
Инструменты для выявления синтетических шпилек присутствуют в готовых наборах miRCURY LNA miRNA PCR Focus и miRNome PCR Panels, могут быть добавлены в качестве контроля в пользовательские панели или заказаны отдельно. Также доступна отдельная ПЦР-панель miRNA QC PCR panel, содержащая комбинацию из 12 проб для количественной ПЦР (РНК-шпилек и эндогенных микроРНК). В ПЦР-панель включена проба для выявления отклонений UniSp3, используемая как межпланшетный калибратор. Строгий контроль качества для NGS обеспечивает набор QIAseq miRNA Library QC PCR Array Kit (Рис. 1).
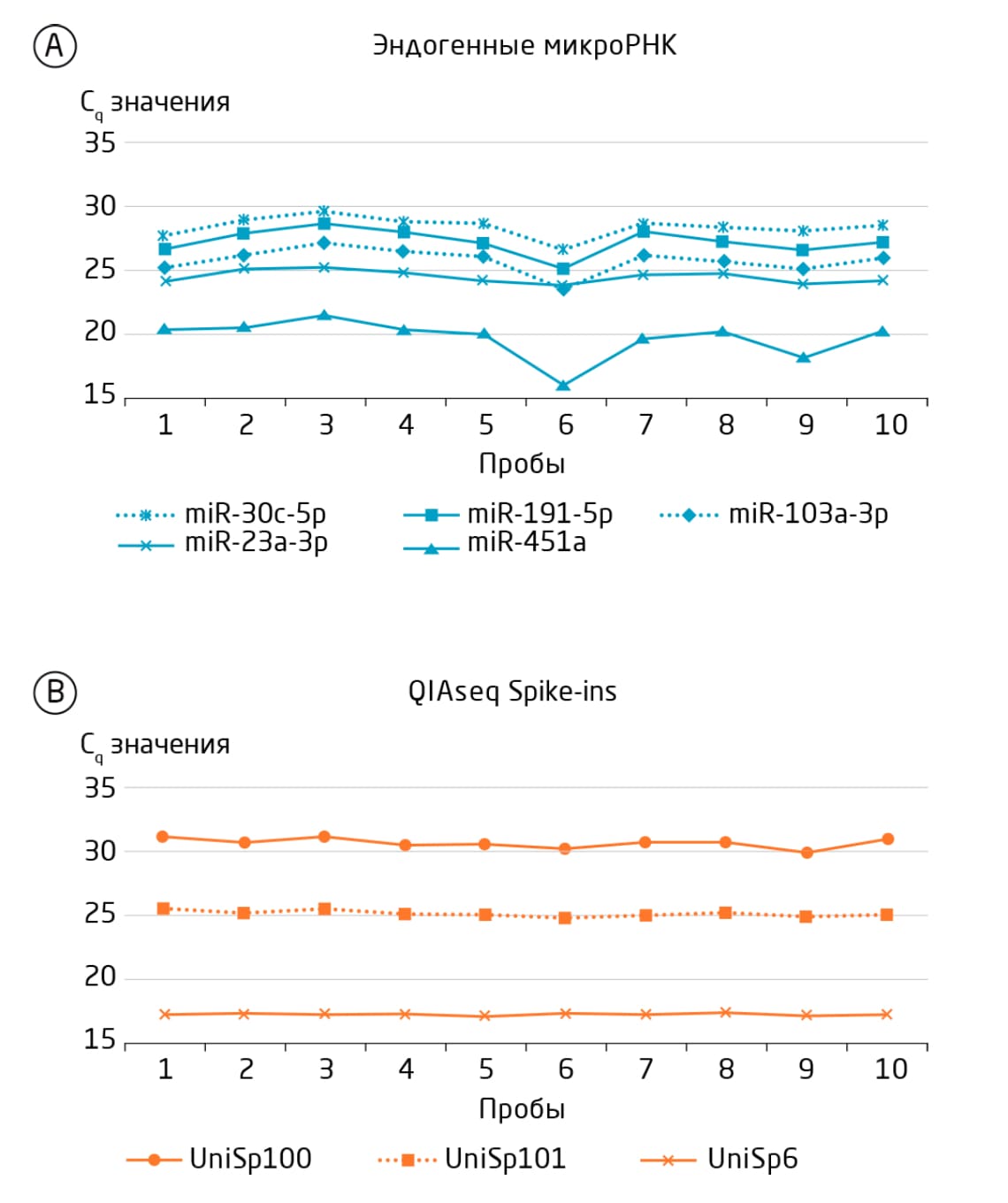
Рис. 1. Анализ QIAseq miRNA Library QC PCR Array обнаруживает эндогенные миРНК и синтетические РНК-шпильки методом количественной ПЦР для тщательной предварительной проверки образцов. A. Образцы с отклонениями и образцы, подвергнутые гемолизу (6 и 9), могут быть легко идентифицированы. B. QIAseq Spike-ins UniSp100 и UniSp101 показывают эффективность выделения РНК, а UniSp6 – наличие ингибиторов. Все представленные образцы, в совокупности, прошли контроль качества.
6. Основные параметры контроля качества
- эффективность выделения РНК её выход;
- отсутствие ингибиторов последующих ферментативных процессов;
- отсутствие нуклеаз;
- наличие или отсутствие РНК в результате клеточного загрязнения или гемолиза;
- наличие эндогенных миРНК, характерных для данного типа биожидкости.
Базовый контроль качества: стандарты для сыворотки и плазмы крови человека
Количество выделенной РНК и остающихся после выделения ингибиторов варьируется от образца к образцу. При профилировании микроРНК в стандартных образцах цельной крови, сыворотки или плазмы человека контролируйте качество всех образцов – любые потенциальные проблемы должны быть выявлены до количественной ПЦР или NGS. Если образцов много, контролируйте качество хотя бы части из них. Базовый контроль качества можно легко выполнить с помощью панели miRCURY LNA miRNA QC PCR Panel, используя одинаковый объём РНК для всех образцов. Образцы с низким выходом РНК, признаками ингибирования или гемолиза можно исключить из дальнейших исследований.
1. Оценка клеточного загрязнения
Присутствие клеточной РНК может нарушить эксперименты по профилированию бесклеточной микроРНК в биожидкости, дать искажённый и невоспроизводимый профиль. Присутствие в профиле РНК, специфичных для белых или красных кровяных клеток, может быть признаком того, что клетки лизировали при выделении РНК (более подробная информация – в разделе «Советы по предотвращению гемолиза»).
Мониторинг гемолиза можно проводить с использованием различных спектрофотометрических методов изменения свободного гемоглобина (раздел «Время обработки от сбора крови до подготовки плазмы/сыворотки». Однако, если РНК уже выделена или исходный образец недоступен, альтернативный подход заключается в сравнении уровня микроРНК, экспрессируемой в эритроцитах (has-miR-451a), с уровнем микроРНК, на которую не влияет гемолиз (hsa-miR-23a-3p). Хорошим показателем степени гемолиза служит ΔCq (miR-23a-3p–miR-451a)
2. Значение ˃5 указывает на возможное загрязнение образца микроРНК эритроцитов, а ΔCq 7-8 и более – на высокий риск влияния гемолиза на результаты анализа для человеческих образцов (для образцов мышей и крыс эти показатели отличаются).
Аналогичный подход пригоден для выявления загрязнений в других образцах биожидкостей. Например, miR-142 считается маркером загрязнения тромбоцитами. Многие микроРНК в сыворотке и плазме крови гемолиз не подвержены влиянию гемолиза, поэтому биомаркеры микроРНК, связанные с заболеванием, можно обнаружить даже в образцах, где гемолиз произошёл. Однако его важно учитывать при нормализации и анализе данных, чтобы исключить любые систематические погрешности.
Расширенный контроль качества: сложные образцы биожидкостей
При создании нового протокола, либо при работе с новым или сложным типом биожидкости, таким как моча или спинномозговая жидкость, мы рекомендуем протестировать различные количества образцов РНК в реакции синтеза кДНК (например, 1, 2, 4 и 8 мкл в 20 мкл ОТ-реакции). Выполните серию разведений с использованием проб для РНК-шпилек и нескольких проб микроРНК (Таблица 2) для подтверждения линейной зависимости между вводимым объёмом и сигналом и последующего определения количества РНК, подходящего для исследований. Образцы, содержащие ингибиторы ПЦР, покажут кривые разбавления без линейной зависимости между вводимым объёмом и сигналом (Рис. 2).
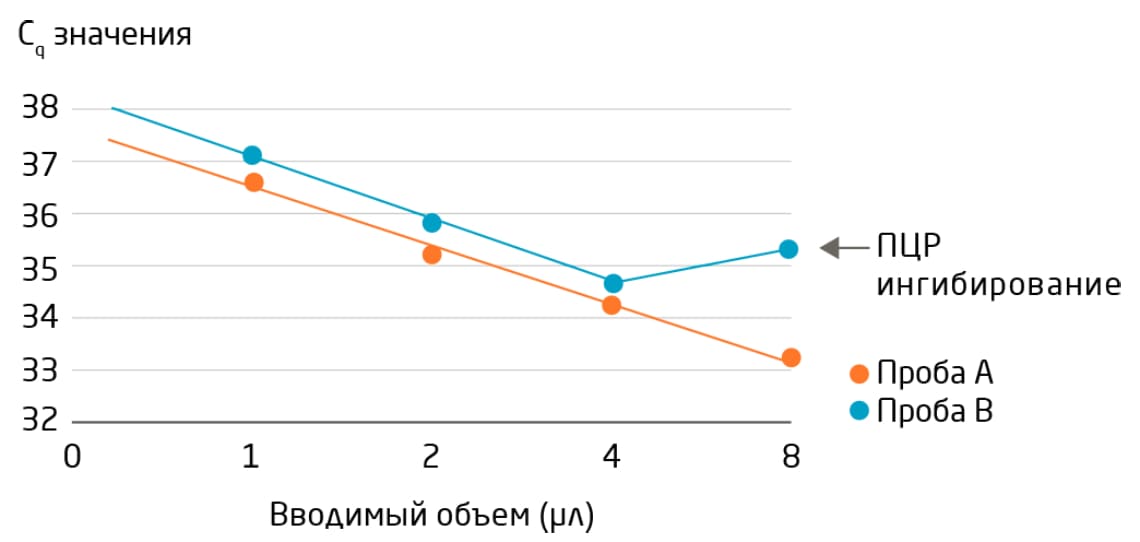
Рис. 2. Определение подходящих вводимых объёмов для достижения линейного диапазона сигнала. Серия разведений РНК может быть использована, чтобы подтвердить, что вводимые объемы находятся в линейном диапазоне системы и обеспечивают хороший уровень сигнала без признаков ингибирования (например, образец А объёмом 8 мкл). Увеличение объема образца для повышения сигнала может иметь обратный эффект – привести к снижению сигнала из-за переноса ингибиторов в ОТ-ПЦР (например, образец B объёмом 8 мкл). Вводимый объем – это объём РНК в 20 мкл ОТ-реакции.
Серия разведений также используется для расчета эффективности или для абсолютного количественного определения микроРНК. Используйте серию разведений РНК, а не серию разведений кДНК. Серия разведений РНК учитывает любые факторы, ограничивающие ОТ-реакцию – лимитирующим шагом часто бывает она, а не количественная ПЦР. Образец РНК рекомендуется разбавлять раствором, содержащим РНК-носитель (например, тотальную РНК бактериофага MS2), чтобы избежать потери РНК из-за адгезии пластика. Для разбавления кДНК перед ПЦР следуйте указаниям в разделе «Протоколы, оптимизированные для биожидкостей» .
Эндогенные микроРНК, подходящие для расширенного контроля качества, перечислены в Таблице 3. После определения оптимального объема образцы следует подвергать контролю качества регулярно – с использованием одного объема и с помощью базового метода.

Таблица 3. Эндогенные микроРНК, обычно обнаруживаемые или стабильно экспрессирующиеся в биологических жидкостях человека. Часто одна или несколько таких микроРНК могут быть полезны для нормализации данных по экспрессии, но стабильность экспрессии этих микроРНК должна быть определена в каждом наборе образцов. МикроРНК, которые мы определили как стабильно экспрессирующиеся в образцах сыворотки/плазмы человека, отмечены звездочкой (*). МикроРНК, которые обычно обнаруживаются, но не обязательно стабильно экспрессируются, отмечены кружком (●).
Литература
1. Debey-Pascher S. et al. Blood-based miRNA preparation for noninvasive biomarker development. Methods in Molecular Biology, 2012.
2. Blondal T. et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids. Methods, 2013.




.jpg)