Медиатека
Полимеразная цепная реакция: как одна технология изменила мир?
Оглавление:
• Историческая справка.
• Полимеразная цепная реакция: принцип работы.
• Анализ результатов ПЦР.
• Применение.
Мы уже успели привыкнуть к тому, что можно быстро и недорого определить причину недомогания, сделать генетический анализ. Но это стало возможно не так давно. Столь резкий прогресс в медицинской диагностике во многом обязан одной технологии, а именно — полимеразной цепной реакции. За время эпидемии коронавируса вы почти наверняка сталкивались с ее аббревиатурой — ПЦР. Чтобы доказать, что вы здоровы, нужно было сделать «ПЦР-тест», подтверждающий отсутствие в организме коронавирусного генетического материала. Именно об этой технологии мы и расскажем в нашей статье.
Историческая справка
Классический метод ПЦР предложил американский биохимик Кэри Муллис (Рис. 1) в 1984 году 1, за что впоследствии был удостоен Нобелевской премии по химии (1993 г.).

Рис. 1. Кэри Муллис: создатель технологии ПЦР.
Источник>>
Однако это открытие было бы невозможно, не будь на тот момент обширной теоретической базы в области молекулярной биологии и смежных областей. Ниже мы кратко резюмируем суть и значение наиболее важных для возникновения ПЦР работ (см. также Рис. 2).
- В 1953 году исследователи Джеймс Уотсон и Фрэнсис Крик опубликовали работу 2, которая внесла существенный вклад в понимание структуры ДНК — молекулы, в которой зашифрована уникальная для каждого организма генетическая информация. Именно эта информация является ключом как к определению вида организма, что необходимо для детектирования патогена, так и к выявлению генетических особенностей и заболеваний человека методом ПЦР.
- В 1950-х гг. Артур Корнберг изучал механизмы репликации, или самоудвоения, ДНК. Ему же удалось впервые осуществить синтез ДНК вне живой клетки, в пробирке. Примечательно, что при проведении ПЦР репликация ДНК тоже осуществляется в искусственных условиях. А в 1957 ученый вместе со своей научной группой выделил из бактерии Escherichia coli первую ДНК-полимеразу 3 – ключевой фермент, обеспечивающий синтез ДНК.
- В 1960-х Хар Гобинд Корана продолжил изучение механизмов синтеза нуклеиновых кислот. В частности, в его лаборатории впервые синтезировали целый ген. Корана продемонстрировал, что такой искусственно созданный фрагмент ДНК нормально функционирует, встроив его в геном Escherichia coli 4. Кроме того, исследователь занимался расшифровкой генетического кода и его роли в синтезе белков.
- В 1969 году Томас Брок и Хадсон Фриз обнаружили новый штамм бактерий Thermus aquaticus, населяющий горячие источники Йеллоустонского национального парка, США 5. Позднее, в 1976 году из этой бактерии был выделен особый тип ДНК-полимеразы: Taq-полимераза 6. Она сохраняет свою активность даже при крайне высоких температурах — выше 75 °C. Использование этой ДНК-полимеразы вместо той, что была найдена у Escherichia coli, ознаменовало новую веху в развитии ПЦР-технологии.
- В 1971 году Хьель Клеппе с коллегами представили теоретическое описание механизма создания множества копий заданного фрагмента ДНК, или амплификации 7. Этот механизм очень близок к тому, что предложил в 1984 году создатель ПЦР Кэри Муллис для своей методики. В связи с этим ему иногда приписывают первенство в изобретении технологии ПЦР.
- В 1977 году Фредерик Сенгер разработал метод определения нуклеотидной последовательности ДНК (секвенирование по Сенгеру), который основан на достройке второй ДНК цепи мечеными нуклеотидами, что позволяет однозначно детектировать их порядок. Идея метода ПЦР пришла Кэри Муллису во время размышлений над секвенированием ДНК.
Эти и другие открытия подготовили почву для того, чтобы в 1984 году Кэри Муллис предложил технологию, позволяющую специфически амплифицировать короткие ДНК-фрагменты в искусственных условиях — метод ПЦР.
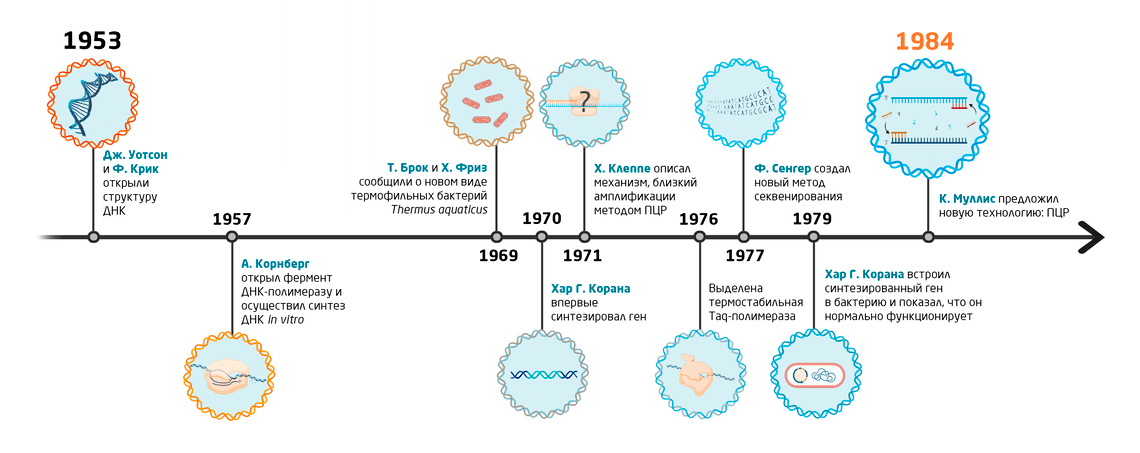
Рис. 2. Хронологическая последовательность ключевых открытий, которые послужили основой для создания технологии ПЦР.
Сегодня, когда метод ПЦР стал неотъемлемой составляющей как биологических наук, так и медицины, практически невозможно представить, что потребовалось немало времени, прежде чем эта методика заслужила внимание специалистов. Между тем, это было именно так! И на то было две основных причины. Во-первых, свое открытие Кэри Муллис совершил в то время, когда работал над секвенированием ДНК (компания Cetus, США). Ученому пришлось изрядно потрудиться, чтобы убедить руководителей в исключительных перспективах разработанного им метода. Во-вторых, ПЦР-технология в том виде, в котором она была предложена Кэри Муллисом, требовала доработки. В частности, первое время в ПЦР использовали ДНК-полимеразу Escherichia coli, которая разрушается при нагревании. Из-за этого полимеразу приходилось добавлять после каждого цикла, что существенно увеличивало как стоимость реактивов, так и времязатраты экспериментатора. Этот недостаток удалось преодолеть в 1986 году, когда Муллис и его научная группа решили использовать Taq-полимеразу, обладающую термоустойчивостью. Были и другие трудности, но их все удалось преодолеть, и со временем ПЦР-технология заняла почетное место среди других успешно применяющихся технологий.
Полимеразная цепная реакция: принцип работы
Несмотря на революционное значение, принцип ПЦР основан на довольно базовых свойствах молекулы ДНК. Чтобы понять этот принцип, необходимо вспомнить, как устроена молекула ДНК и как осуществляется ее удвоение в клетке — репликация. ДНК представляет собой длинный полимер, состоящий из нуклеотидов — своего рода букв алфавита, — на котором записана вся генетическая информация о нашем организме. Только разных букв — нуклеотидов — в этом алфавите всего 4: аденин (А), тимин (Т), гуанин (Г) и цитозин (Ц). Нуклеотиды в составе ДНК образуют две нити, которые комплементарно связаны между собой: нуклеотид А в одной цепи строго соответствует нуклеотиду Т в другой цепи, а Г соответствует Ц (Рис. 3А).
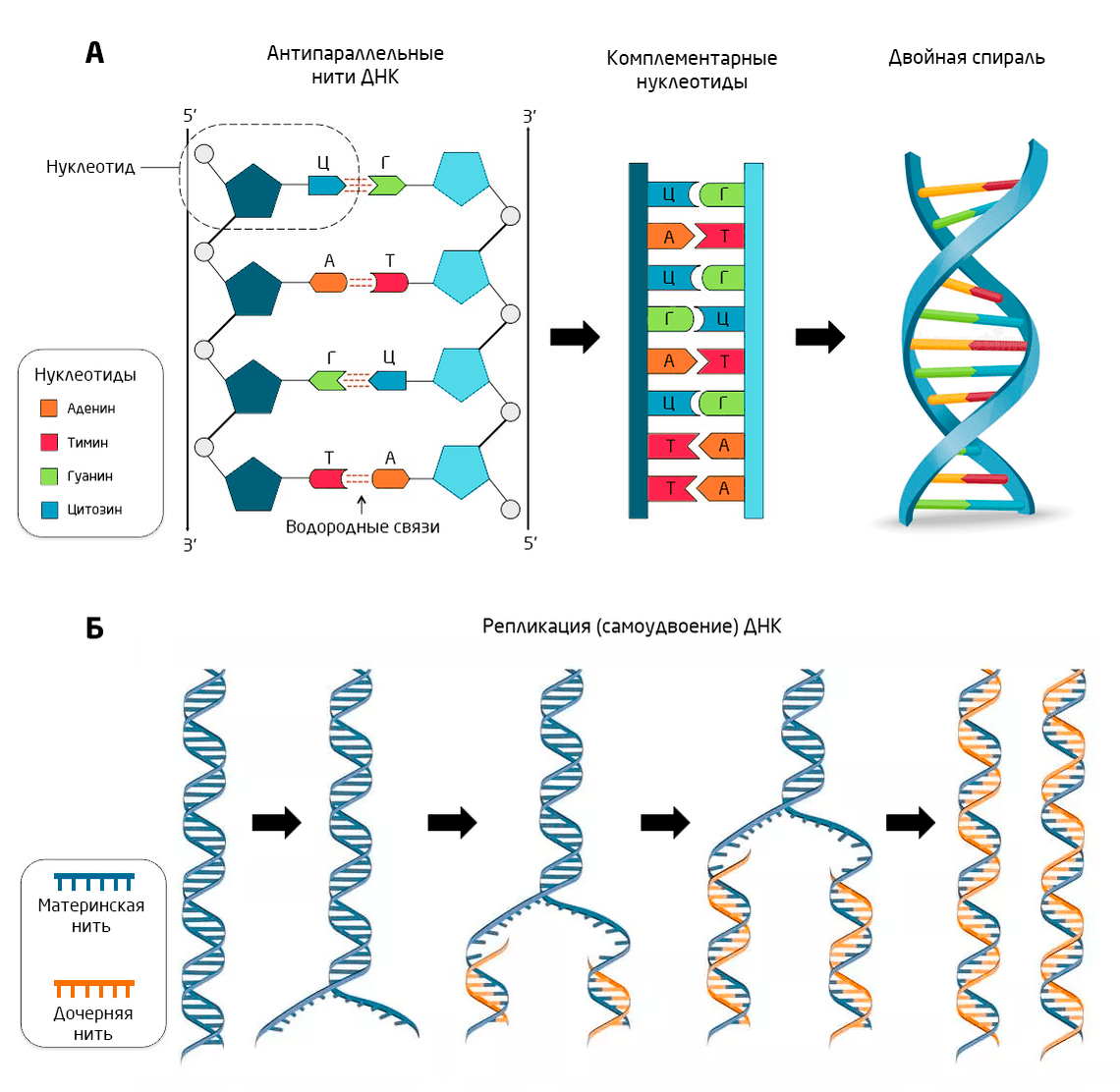
Рис. 3. А: Строение молекулы ДНК. Б: Общая схема репликации ДНК в живой клетке.
Источник 1>>,
Источник 2>>.
В результате такого кодирования обе цепи ДНК несут одинаковую информацию, хоть и записанную разными буквами. Это имеет особенно важное значение для деления: обе дочерние клетки должны получить идентичную генетическую информацию. Поэтому перед делением клетки происходит репликация — молекула ДНК разделяется на две материнские нити, и на них, как на матрице, комплементарно достраиваются новые дочерние нити ДНК. В результате происходит удвоение генетического материала (Рис. 3Б).
На таком же принципе разделения и удвоения ДНК основан и метод ПЦР. При ПЦР для инициации синтеза дочерней цепи используют праймеры — короткие (18-25 пар нуклеотидов, п.н.) ДНК-фрагменты, комплементарные началу материнской цепи. Присоединение праймеров позволяет ДНК-полимеразе сесть на образовавшийся двухцепочечный фрагмент и продолжить синтез до достижения терминирующего триплета или до прекращения поддержания оптимальных для репликации условий. В отличие от удвоения ДНК в живой клетке, методом ПЦР можно синтезировать лишь небольшой фрагмент ДНК. Как правило, порядка 10 тысяч п.н. (для сравнения, длина ДНК в клетке человека составляет около 3 миллиардов п.н.). Выделение нужного ДНК участка для амплификации методом ПЦР осуществляется подбором двух различных праймеров. Так как синтез на двух цепях ДНК идет антипараллельно, т.е. в разных направлениях, то один праймер должен быть комплементарен началу искомого ДНК-фрагмента на первой материнской цепи, а второй — началу того же фрагмента на второй цепи (Рис. 4).
Таким образом, необходимые компоненты для проведения ПЦР включают:
1. Матрицу ДНК, содержащую фрагмент, который нужно амплифицировать;
2. Два праймера, ограничивающие амплифицируемый ДНК фрагмент;
3. ДНК-полимеразу (например, термостабильную Taq-полимеразу);
4. Нуклеотиды (А, Т, Г, Ц), которые пойдут на строительство дочерних цепей ДНК;
5. Буфер с рН~8.4 и определенной концентрацией ионов (Mg2+ и др.).
Выбор подходящей ДНК-полимеразы определяется целями эксперимента. Например, если требуется создание точной копии гена, важно использовать фермент, способный корректировать ошибки репликации. Иногда выгодно использовать смеси двух или более ДНК-полимераз. Например, если проводится амплификация длинных ДНК-фрагментов.
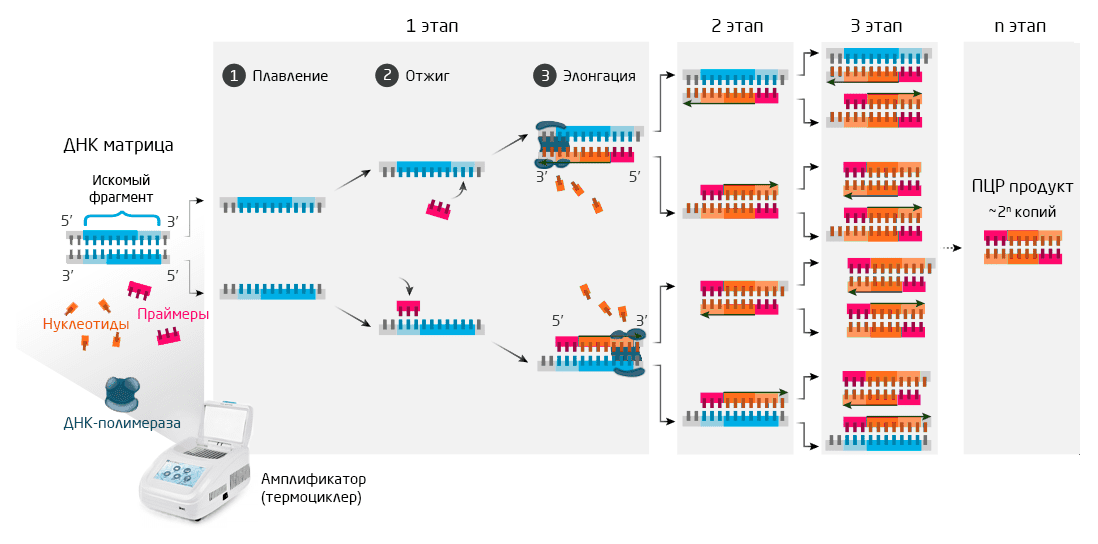
Рис. 4. Общая схема ПЦР. Необходимые компоненты помещаются в амплификатор, где в результате многократного повторения трех этапов реакции происходит увеличение числа искомых фрагментов ДНК.
Источник>>
Все названные компоненты смешивают в определенной пропорции в пробирке или 96-луночном планшете и затем помещают в специальный прибор — амплификатор. В нем обеспечивается поддержание температуры на определенном уровне, который оптимален для протекания реакции на каждой из трех стадий ПЦР: плавления, отжига и элонгации (см. Таблицу 1 и Рис. 4):
| Название стадии | Температура, °C | Длительность, мин | Что происходит? |
| Плавление | 94-95 | 0.5-2 | Нагревание до высоких температур приводит к разрыву водородных связей, связывающих две нити ДНК, и образованию однонитевых ДНК матриц и праймеров. Чем больше в ДНК Г+Ц оснований, тем выше температура и больше длительность этого этапа. |
| Отжиг | 45-60 | 0.5-2 | Снижение температуры приводит к связыванию праймеров с комплементарными им участками однонитевых ДНК матриц, соответствующими целевому фрагменту. При неправильном подборе температуры праймеры могут связаться с неправильным участком, образовать вторичные структуры (шпильки и т.п.) или вообще не связаться с ДНК. |
| Элонгация | 70-72 | * | Повышение температуры до оптимальной для работы ДНК-полимеразы ведет к инициации синтеза дочерних цепей. Таким образом, на каждой стадии элонгации число копий искомого фрагмента ДНК увеличивается в два раза. |
| *Длительность стадии зависит от длины ДНК фрагмента с расчетом ~1 минута на каждые 1000 нуклеотидов в ДНК цепи. | |||
Таблица 1. Стадии ПЦР амплификации 8, 9, 10
Амплификация ограниченного праймерами участка ДНК достигается многократным повторением трех стадий ПЦР благодаря тому, что в каждом новом цикле к уже имеющимся ДНК-матрицам добавляются новосинтезированные на предыдущем этапе элонгации.
Максимальное число таких ПЦР-циклов с удвоением ограничено не только количеством нуклеотидов, но и наличием ингибиторов реакции в пробе, свойствами выбранной ДНК-полимеразы и некоторыми другими факторами 9. Как правило, для получения необходимого количества ДНК-фрагментов достаточно 25-40 циклов ПЦР 8, 9. В каждом цикле число ДНК копий равно 2n, где n — порядковый номер цикла.
Анализ результатов ПЦР
ПЦР в его классическом виде используют, чтобы определить наличие или отсутствие определенного ДНК фрагмента в имеющейся пробе. Есть два основных метода, позволяющих однозначно ответить на этот вопрос с помощью визуализации ПЦР-продукта
11:
1. Окрашивание ДНК в пробе с помощью бромистого этидия, который встраивается между двумя комплементарными нитями ДНК.
2. Мечение праймеров или нуклеотидов флуоресцентными красителями перед проведением ПЦР. В этом случае визуализируется именно продукт ПЦР, но не исходные ДНК-матрицы.
После окрашивания или мечения для разделения ПЦР-продуктов обычно проводят электрофорез в агарозном или полиакриламидном геле (Рис. 5А). Электрическое поле заставляет амплифицированные отрицательно заряженные ДНК-фрагменты двигаться к положительно заряженному полюсу. Скорость их движения будет определяться молекулярной массой и зарядом, так что более мелкие и отрицательно заряженные ДНК-фрагменты пробегут большее расстояние за отведенное время. В результате смесь ПЦР-продуктов разделяется на полосы, которые становятся видимыми под действием ультрафиолета. Сравнивая их со стандартными образцами, можно вычислить молекулярную массу образовавшихся в ходе ПЦР ДНК-фрагментов (Рис. 5Б) 8.
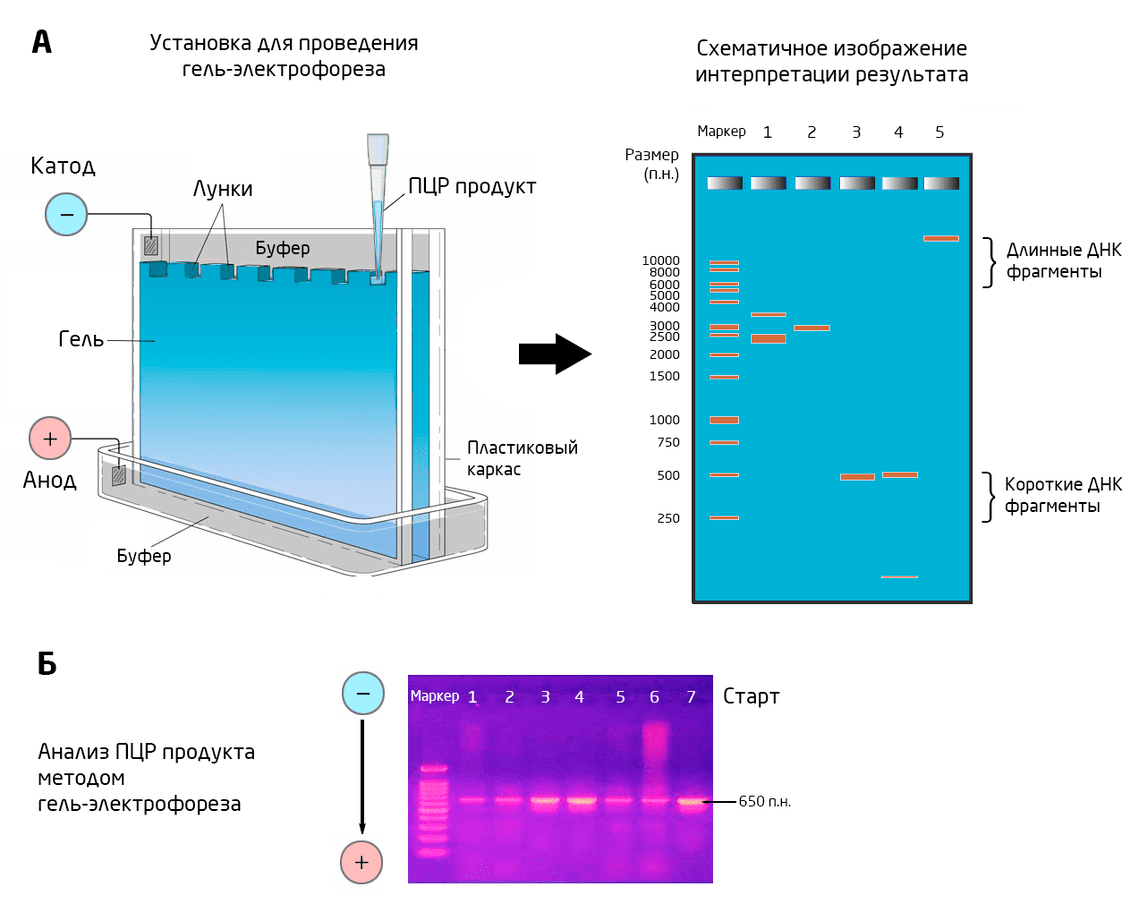
Рис. 5. Разделение ДНК-фрагментов методом гель-электрофореза. А: Схема установки и интерпретации результата. Б: Фотография реального разделения образца гель-электрофорезом.
Источник 1>>,
Источник 2>>,
Источник 3>>.
Применение
ПЦР-технология используется как для осуществления грандиозных проектов (например, «Геном человека»), так и для повседневных клинических и научно-исследовательских нужд. Сегодня ПЦР широко используется для следующих задач:
1. Клонирование ДНК
Для получения большого количества некоторого белка, например, инсулина — лекарства для пациентов с сахарным диабетом 2-го типа, в ДНК микроорганизмов встраивают ген, отвечающий за синтез этого белка. ПЦР позволяет многократно амплифицировать этот ген, увеличивая тем самым вероятность его встраивания. Такие генетически модифицированные микроорганизмы превращаются в молекулярные «фабрики» и, размножаясь, обеспечивают производство инсулина (Рис. 6А). 12
2. Диагностика инфекционных и паразитарных заболеваний
Амплификация участков ДНК, специфичных для определенных вирусов, бактерий и других паразитарных организмов, позволяет однозначно определить инфицирование данным возбудителем и поставить диагноз. Например, с помощью ПЦР можно обнаружить коронавирус (Рис. 6Б), гепатит, вирус иммунодефицита человека, туберкулез, малярию, токсоплазму и другие заболевания. 8, 13
3. Выявление мутаций
Помимо патогенов, заболевания могут быть вызваны генетическими факторами. Например, мутациями — изменениями в нуклеотидной последовательности ДНК. Метод ПЦР позволяет выявить наличие определенной ДНК последовательности с мутацией и подтвердить диагноз. 14
4. Секвенирование
Определение нуклеотидной последовательности ДНК позволяет обнаружить новый вид или выяснить степень родства между уже известными видами. Так, используя ПЦР, Castiliego et al. (2015) 15 идентифицировали целых семь различных видов рыб-удильщиков. Кроме того, ПЦР-анализ может дать ответ на вопрос что же мы на самом деле едим. С его помощью проводят определение реального состава пищевых продуктов, что важно для проверки их маркировки. 16
5. Работа с малым количеством ДНК материала
Важное свойство ПЦР — это возможность амплификации ДНК даже в условиях совсем небольшого объема исходного генетического материала. Это особенно важно, когда количество ДНК ограничено. Например, если перед вами редкий образец, клинический материал или ДНК с места преступления. Всего одной капли крови или волоса достаточно, чтобы амплифицировать заданные фрагменты генетического материала и продолжить анализ.
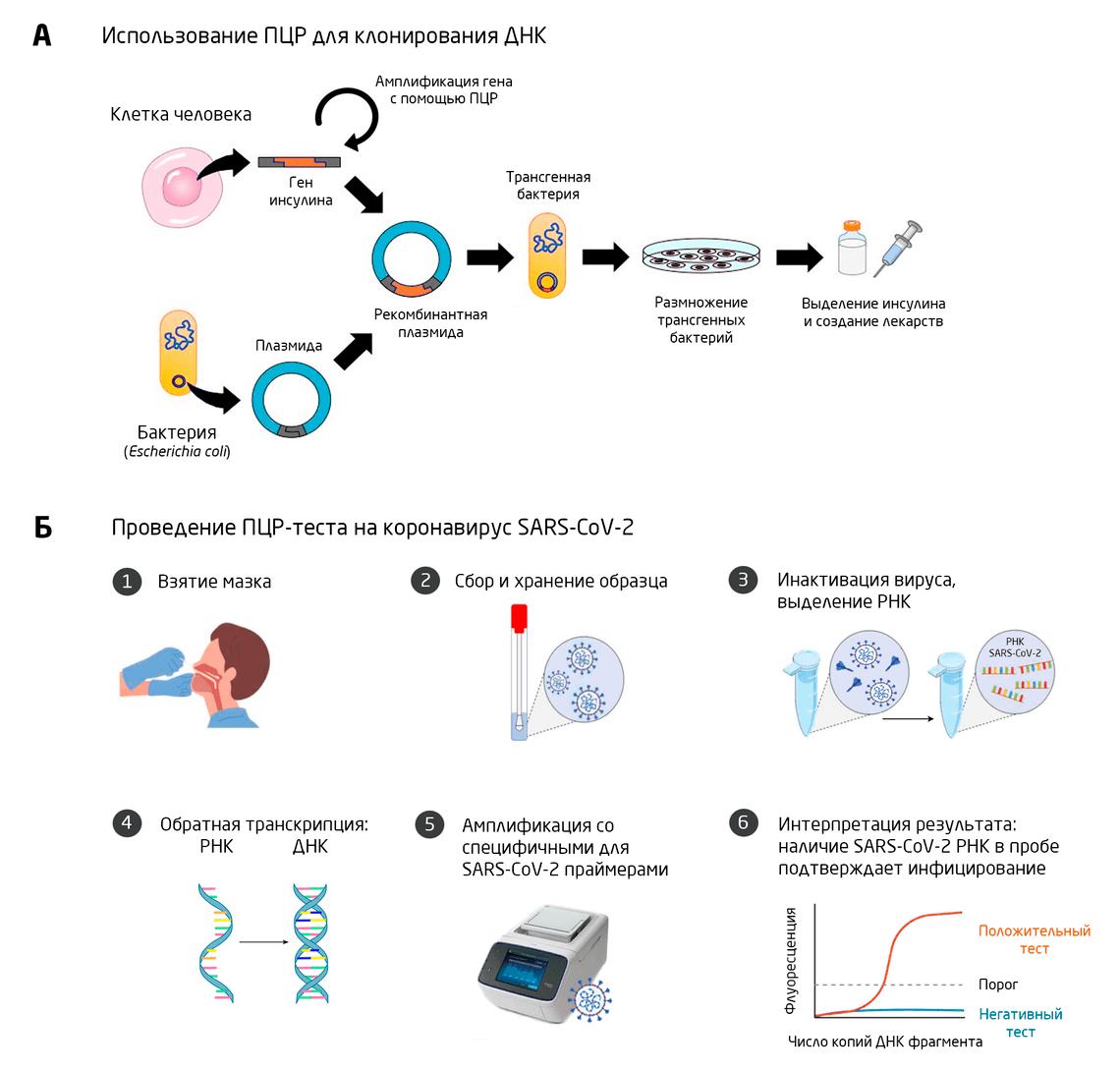
Рис. 6. Использование метода ПЦР для А: клонирования ДНК и Б: диагностики новой коронавирусной инфекции, вызванной SARS-CoV-2.
Источник 1>>,
Источник 2>>.
Открытие метода ПЦР радикально изменило биологические и медицинские науки. Преимущества ПЦР в сравнении с другими методами — это простота, доступность и относительная дешевизна компонентов, сочетающиеся с высокой чувствительностью и специфичностью метода. При этом в современном варианте ПЦР протекает достаточно быстро — получить миллиарды фрагментов ДНК из всего одной копии можно за 45-60 минут, завершив 40 ПЦР-циклов 17. И, хотя технология ПЦР была предложена почти 40 лет назад, она до сих пор остается актуальной, продолжая адаптироваться под новые задачи, которые ставят перед собой наука и медицина.
Литература
1. Mullis K.B. The unusual origin of the polymerase chain reaction. Scientific American, 1990.
2. Watson J.D., Crick F.H. Molecular structure of nucleic acids: a structure for deoxyribose nucleic acid. Nature, 1953.
3. Lehman I.R. et al. Enzymatic synthesis of deoxyribonucleic acid: I. Preparation of substrates and partial purification of an enzyme from Escherichia coli. Journal of Biological Chemistry, 1958.
4. Khorana H.G. et al. Total synthesis of the structural gene for the precursor of a tyrosine suppressor transfer RNA from Escherichia coli. 1. General introduction. Journal of Biological Chemistry, 1976.
5. Brock T.D., Freeze H. Thermus aquaticus gen. n. and sp. n., a nonsporulating extreme thermophile. Journal of Bacteriology, 1969.
6. Chien A., Edgar D.B., Trela J.M. Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus. Journal of Bacteriology, 1976.
7. Kleppe K. et al. Studies on polynucleotides: XCVI. Repair replication of short synthetic DNA's as catalyzed by DNA polymerases. Journal of Molecular Biology, 1971.
8. Shahi S. et al. Polymerase chain reaction (PCR)-based methods: promising molecular tools in dentistry. International Journal of Biological Macromolecules, 2018.
9. Green M.R., Sambrook J. Polymerase chain reaction. Cold Spring Harbor Protocols, 2019.
10. Mubarak S.M. et al. An optimization and common troubleshooting solving in polymerase chain reaction technique. Systematic Reviews in Pharmacy, 2020.
11. Garibyan L., Avashia N. Research techniques made simple: polymerase chain reaction (PCR). The Journal of Investigative Dermatology, 2013.
12. Govender K. et al. A novel and more efficient biosynthesis approach for human insulin production in Escherichia coli (E. coli). AMB Express, 2020.
13. Rahman M.T. et al. Polymerase chain reaction (PCR): a short review. Anwer Khan Modern Medical College Journal, 2013.
14. Morlan J., Baker J., Sinicropi D. Mutation detection by real-time PCR: a simple, robust and highly selective method. PloS One, 2009.
15. Castigliego L. et al. Two alternative multiplex PCRs for the identification of the seven species of anglerfish (Lophius spp.) using an end-point or a melting curve analysis real-time protocol. Food Chemistry, 2015.
16. Vietina M., Agrimonti,C., Marmiroli N. Detection of plant oil DNA using high resolution melting (HRM) post PCR analysis: A tool for disclosure of olive oil adulteration. Food Chemistry, 2013.
17. Bustin S.A. How to speed up the polymerase chain reaction. Biomolecular Detection and Quantification, 2017.




.jpg)