Медиатека
Факторы Яманака – молекулы, обратившие время вспять
Оглавление:
•
Уникальные и универсальные стволовые клетки
•
Нобелевская премия за «эликсир молодости»
•
Технологии получения ИПСК и их эволюция
•
Успехи и практическое использование технологий ИПСК
Путешествия сквозь пространство и время, машина времени – излюбленная тема писателей-фантастов, сценаристов кино и просто мечтателей. Пока физики пытаются освоить перемещение во времени, ученые-биологи используют законы природы для «отправки» своих подопечных (правда, пока только отдельных клеток) в их далекое клеточное «детство», когда они были совсем юными, не дифференцированными стволовыми клеточками. О том, как это стало возможным и зачем нужно, мы расскажем в нашем обзоре.
Уникальные и универсальные стволовые клетки
По разным теоретическим подсчетам в теле взрослого человека насчитывается несколько десятков триллионов клеток (без учета клеток-симбионтов) и каждая – уникальна и необходима! Несмотря на их многочисленность и многообразие, все они произошли из единственной клетки – одноклеточной зиготы. Зигота в процессе деления дает начало уникальному поколению клеток – стволовых (СК), которые в дальнейшем формируют все клетки будущего организма. На ранних стадиях эмбриогенеза (4-7 дни развития) клетки зародыша, которые называют эмбриональными стволовыми клетками (ЭСК), однородны и обладают уникальным свойством становиться клеткой любого типа – плюрипотентностью. Последующие циклы делений и дифференцировки приводят к потере этого свойства и строгой «специализации» клеток, формируя ткани, органы, системы органов, в итоге рождая единый функционирующий организм. 1
Рис. 1. Общая схема дифференцировки стволовых клеток.
Источник 1;
Источник 2
Однако не все клетки дифференцируются в течение жизни. В тканях организма остаются популяции стволовых клеток, которые необходимы для регенерации и обновления ткани. Эти стволовые клетки обладают уникальным набором свойств, таких как неограниченное, но контролируемое число делений, особый тип метаболизма, способность к дифференцировке, миграции и т.д. Они уже не являются плюрипотентными, но все еще способны давать начало более ограниченному типу клеток, являясь мультипотентными.
Уникальные свойства ЭСК и СК сделали их идеальными кандидатами для применения в регенеративной медицине, в лечении различных дегенеративных заболеваний, борьбе с возрастными изменениями и омоложении организма. В теории всё выглядит очень просто – необходимо выделить стволовые клетки и доставить их в нужное место (например, раневую поверхность), где они начнут делиться, дифференцироваться и восстанавливать исходную структуру тканей, повреждённых или даже отсутствующих участков органов. Действительно, стволовые клетки можно было бы считать панацеей, если бы на практике не пришлось столкнуться с рядом серьезных ограничений и последствий. Например, этические и законодательные запреты на получение биоматериала из эмбрионов, сложность получения и низкий выход СК из зрелой ткани, непредсказуемые последствия трансплантации стволовых клеток пациентам вплоть до возникновения онкологических заболеваний, бесконтрольное применение СК в целях финансового обогащения недобросовестными медицинскими организациями и т.д.
К счастью, современные научные подходы позволяют преодолевать некоторые из этих ограничений, что увеличивает шансы на успешное и светлое будущее для технологий СК. Так, одним из прорывов в этой области заслуженно считается получение особого типа плюрипотентных стволовых клеток путем репрограммирования дифференцированных клеток методами генной инженерии 2. То есть «взрослую» клетку фактически возвращают в состояние стволовой. Такие клетки называются индуцированными плюрипотентными стволовыми клетками (ИПСК). По своим характеристикам и потенциалу они не уступают эмбриональным СК.
Нобелевская премия за «эликсир молодости»
Получение ИПСК стало одним их самых значимых и важных событий в биологии, и обязаны мы этому открытию группе японских ученых во главе с Синьей Яманака, которые долгие годы кропотливо трудились в лаборатории в попытках понять, какие гены являются специфичными для ЭСК и ответственными за плюрипотентность. Масштабная работа по идентификации и верификации таких генов позволила в 2006 году путем «включения» нескольких из них получить первые ИПСК из мышиных эмбриональных фибробластов 2.
Рис. 2. Синья Яманака: лауреат Нобелевской премии по физиологии и медицине 2012 года.
Источник
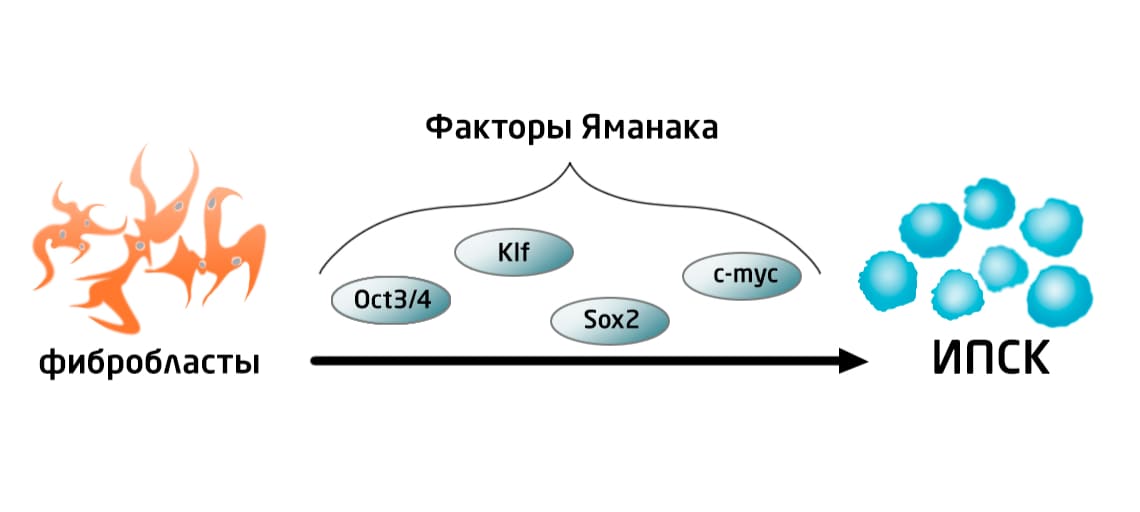
Из 24 генов-кандидатов, отобранных для экспериментальной проверки, удалось выделить всего 4 гена, необходимых для полной де-дифференцировки. Гены, кодирующие транскрипционные факторы Oct3/4, Sox2, c-myc и Klf стали известны как «факторы Яманака», или OSKM-факторы, и принесли ученому Нобелевскую премию в 2012 году. Следующим шагом стало получение человеческих ИПСК и сделано это было параллельно двумя группами ученых. Помимо группы Яманака, добившейся репрограммирования человеческих клеток с помощью OSKM-факторов, американские ученые под руководством Джеймса Томсона сообщили о получении человеческих ИПСК с использованием альтернативных факторов (OCT3/4, SOX2, NANOG, LIN28). Оба набора факторов сейчас широко используются, а их комбинация дает синергетический эффект на образование человеческих ИПСК. 3
Технологии получения ИПСК и их эволюция
С момента своего появления в 2006 году технологии получения ИПСК быстро развивались. Поскольку ИПСК первоначально были созданы путем введения репрограммирующих факторов с использованием вирусных векторов на основе ретровирусов и лентивирусов, сразу возникли опасения по поводу клинического использования этих ИПСК из-за потенциального инсерционного мутагенеза в случае интеграции трансгенов в геном клеток-хозяев. Чтобы сделать ИПСК клинически применимыми и обойти риски, связанные с вирусной трансдукцией, были разработаны различные не интегрирующие методы. Эти методы включают репрограммирование с использованием эписомальных ДНК, аденовирусов, вируса Сендай, транспозонов PiggyBac, кольцевых мини-векторов, рекомбинантных белков, синтетических модифицированных мРНК, микроРНК и малых молекул. Все эти подходы сделали процедуру получения ИПСК гораздо более эффективной и безопасной. 4
Несмотря на то, что для полного репрограммирования клеток необходимо всего несколько факторов, эффективность выхода изначально была очень низкой – лишь доли процента клеток в эксперименте образовывали колонии ИПСК. Дальнейшие силы ученых были направлены на то, чтобы облегчить процедуру репрограммирования и повысить её эффективность. Это удалось сделать с привлечением ряда других генов, ассоциированных с плюрипотентностью, а также нижеследующих мишеней самих OSKM-факторов. Также оказалось, что белки-регуляторы клеточного цикла и эпигенетические регуляторы значительно (как положительно, так и негативно) влияют на переход клеток в плюрипотентное состояние. Воздействие на некоторые из них низкомолекулярными веществами позволило существенно увеличить эффективность и сократить время образования ИПСК. Высокую активность показали ингибиторы гистоновых ацетилаз, ингибиторы VEGFR, ингибиторы ROCK, активаторы HIF-пути, стимуляторы гликолитического метаболизма и другие вещества. Когда ИПСК удалось получить только с помощью комбинации 7 малых молекул (среди них агонисты цАМФ и эпигенетические регуляторы) без использования белковых факторов, была совершена поистине технологическая революция. 5
Рис. 3. Репрограммирование клеток с помощью факторов Яманака.
Стоит отметить, что работа со стволовыми клетками и ИПСК, их получение и культивирование, отличается от работы со «стандартными» лабораторными клеточными линиями и требует особых условий. Специально для них разработаны клеточные среды особого состава, в которых отсутствуют вещества животного происхождения, способные влиять на свойства СК и стимулировать дифференцировку. Культивирование клеток происходит на специальном субстрате, необходимом для адгезии и поддержания недифференцированного состояния СК. В качестве такого субстрата может выступать фидер – слой инактивированных клеток, обычно эмбриональных фибробластов мыши, или слой из комплекса белков внеклеточного матрикса и протеогликанов. Часто приходится отказываться от антибиотиков и индикаторных красителей в культуральных средах, что требует неукоснительного соблюдения стерильных условий работы.
Успехи и практическое использование технологий ИПСК
Как уже упоминалось, стволовые клетки и ИПСК обладают огромным потенциалом для использования в научных, медицинских и косметических целях. И этот потенциал постепенно раскрывается, демонстрируя особые успехи в нескольких направлениях: моделирование заболеваний, поиск и тестирование лекарств, клеточная терапия и регенеративная медицина.
Выявление патологических механизмов, лежащих в основе заболеваний человека, играет ключевую роль в разработке новых терапевтических стратегий. Часто для этого используют клеточные модели, и ИПСК являются привлекательной альтернативой первичным клеткам, так как их можно получить из легкодоступных типов клеток, таких как фибробласты кожи и клетки крови. При этом благодаря свойствам ИПСК дифференцироваться в любой тип клеток можно получить в большом количестве ранее недоступные клетки, такие как нейроны и кардиомиоциты. Кроме того, такой подход обеспечивает персонолизированное моделирование заболевания, а значит, и более эффективное лечение для конкретного пациента.
Моделирование заболевания человека начинается с получения от пациента ИПСК, содержащих мутацию или мутации, вызывающие заболевание. Затем эти клетки дифференцируются в типы клеток, соответствующие заболеванию. Полученные клетки используются для выявления этиологии заболевания и идентификации патологических механизмов. Быстро развивающиеся технологии редактирования генома теперь позволяют вводить направленные сайт-специфические генетические изменения в ИПСК. При этом возможно как исправление вызывающих заболевание генных мутаций в ИПСК, полученных от пациентов, так и введение специфических мутаций в ИПСК, полученных из здоровых клеток.
Клеточные модели с использованием ИПСК уже получены для таких заболеваний, как спинальная мышечная атрофия (СМА), болезни Альцгеймера и Паркинсона. Предпринимаются попытки моделировать такие заболевания, как шизофрения и латеральный амиотрофический склероз (ЛАС), используя сочетание нескольких типов клеток для более полного отображения фенотипа заболевания.
Взаимодействия между различными типами клеток в более физиологичном контексте и окружении можно смоделировать с помощью 3D-органоидов. Такие органоиды были созданы из ИПСК для многих органов, включая мозг, сетчатку, кишечник, почки, печень, легкие и желудок и использовались для моделирования развития и заболеваний органов человека (микроцефалии, глаукомы, муковисцидоза, гастрита, заболеваний аутического спектра, синдрома Секкеля, инфицирование вирусом Зика и других), тестирования терапевтических соединений и трансплантации клеток.
Моделирование заболевания направлено как на выяснение причин и молекулярных механизмов заболевания, так и на поиски лекарственных средств для их лечения, поэтому ИПСК-модели стали популярными объектами в тестировании различных соединений на активность и токсичность, включая широкомасштабные скрининги. Несколько таких исследований уже увенчались успехами и найденные вещества, в том числе против СМА и ЛАС, проходят клинические испытания.
Значительный интерес вызывают возможности регенеративной медицины, основанной на использовании стволовых клеток и ИПСК для стимуляции эндогенных регенеративных процессов или замещения поврежденных тканей после клеточной трансплантации. Клеточная терапия с использованием ИПСК показала высокую эффективность и безопасность в лечении ряда заболеваний, таких как болезнь Паркинсона, возрастная макулярная дегенерация, рак груди, мозга, яичников, тяжелая сердечная недостаточность и апластическая анемия. Текущие терапевтические исследования находятся на разных стадиях клинических испытаний. 6, 7, 8
Резюмируя, можно сказать, что с получением СК и ИПСК в медицине началась новая эра, в которой стало возможным смоделировать, изучить и даже «вылечить» различные заболевания «в пробирке» на уровне клеток и искусственных органоидов. Это позволило вывести на новый уровень исследования многих заболеваний со сложной этиологией, включая серьезные сердечно-сосудистые и нейродегенеративные заболевания, имеющие нарастающие показатели по заболеваемости и смертности во всем мире. Поэтому не вызывает сомнений то, что прогресс в области ИПСК наряду с другими технологиями, такими как CRISPR/Cas9 (подробнее о системе CRISPR/Cas9 читайте в нашей статье «Система CRISPR/Cas – от идеи к практике»), трехмерные органоиды и микроРНК-переключатели, будет способствовать дальнейшему ускорению и без того быстрого темпа моделирования заболеваний и разработки эффективных терапевтических средств.
Литература
1. Гривенников И.А. Эмбриональные стволовые клетки и проблема направленной дифференцировки. Успехи Биологический Химии, 2008.
2. Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006.
3. Takahashi K., Yamanaka S. A decade of transcription factor-mediated reprogramming to pluripotency. Nature Reviews Molecular Cell Biolog, 2016.
4. Shi Y., Inoue H., Wu J.C., Yamanaka S. Induced pluripotent stem cell technology: a decade of progress. Nature Reviews Drug Discovery, 2017.
5. Chen G. et al. Small Molecules that Promote Self-Renewal of Stem Cells and Somatic Cell Reprogramming. Stem Cell Reviews and Reports, 2020.
6. Ohnuki M, Takahashi K. Present and future challenges of induced pluripotent stem cells. Philosophical Transactions of the Royal Society B: Biological Sciences, 2015.
7. Kim J.Y. et al. Review of the Current Trends in Clinical Trials Involving Induced Pluripotent Stem Cells. Stem Cell Reviews and Reports, 2022.
8. Kim C. iPSC technology - Powerful hand for disease modeling and therapeutic screen. BMB Reports, 2015.




.jpg)