Медиатека
Эволюция билатерально-симметричных животных: кто был первым – личинка или взрослая особь?
Оглавление:
• Теории происхождения метаморфоза
• Методы и результаты исследования
• Развитие туловища и гетерохрония регуляции генов Hox
• Гетерохрония – ключевой механизм в эволюции билатерально-симметричных животных
Развитие с метаморфозом – сложный и уникальный с точки зрения эволюции процесс. Он обнаруживается практически во всех линиях многоклеточных (Metazoa). Личинки животных, которые развиваются с превращением, по своему анатомическому строению и функционированию часто кардинально отличаются от взрослых особей. Например, личинки у морских беспозвоночных с непрямым развитием, как правило, являются планктонными фильтраторами, тогда как взрослые особи малоподвижны и обитают в грунте водоёмов (бентосные формы) (рис. 1). Это заставило учёных задуматься, как всё же выглядели предки таких животных – были они похожи на личинок, которые затем приобрели взрослые черты, а личиночные свойства сохранились только на ранних этапах онтогенеза, или же они обладали планом строения взрослых животных, который по мере «упрощения» дал начало личинкам с относительно примитивной физиологией?
1,
2
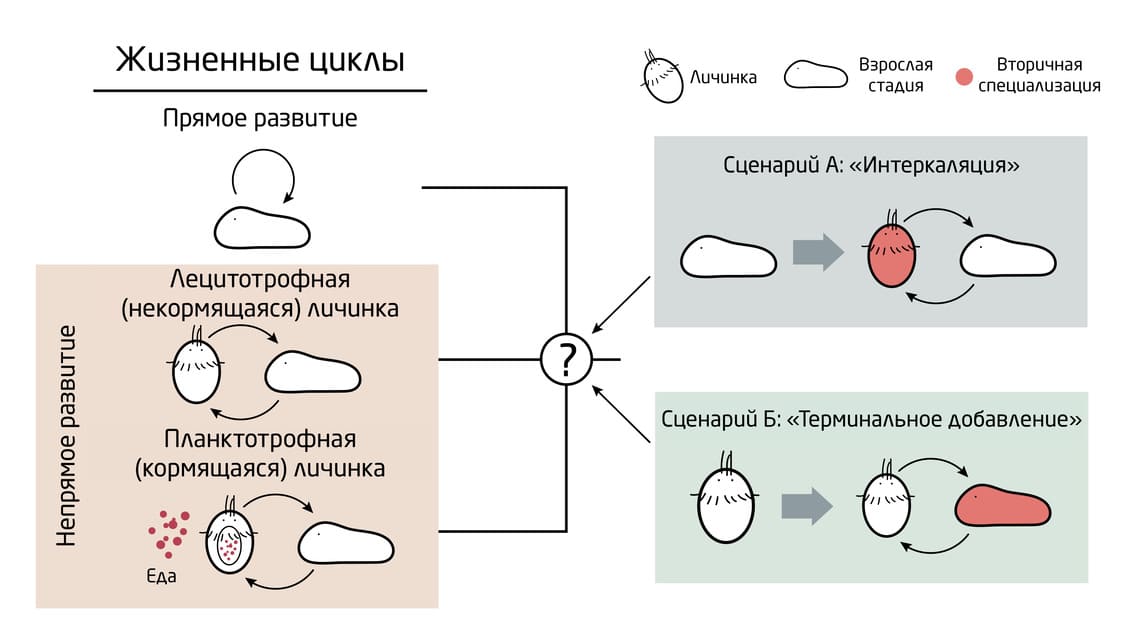
Рис. 1. Жизненные циклы и личиночные формы билатеральных животных. При непрямом развитии существует два варианта питания личинок: лецитотофные получают питательные вещества из желтка, а планктотрофные – из планктона.
6
Теории происхождения метаморфоза
Сегодня для объяснения этого феномена предложены две гипотезы. В основе гипотезы «первичной личинки» лежит биогенетический закон Геккеля, или закон эмбриональной рекапитуляции, согласно которому онтогенез является повторением этапов филогенеза. Другими словами, все живые существа в процессе эмбрионального развития повторяют стадии эволюционного развития своего вида.
Из этого следует предположение, что первые многоклеточные животные были похожи на личинок, для которых характерна радиальная симметрия тела, и обитали в толще или на поверхности воды. В процессе эволюции предковые формы постепенно опускались на дно, теряя подвижность и обретая двустороннюю симметрию. Это сопровождалось появлением особых имагинальных недифференцированных клеток, которые на стадиях эмбриона и личинки находятся в покоящемся состоянии и активируются в процессе метаморфоза, давая начало тканям «взрослой стадии».
На генетическом уровне формированию двусторонней симметрии способствовало изменение регуляции генов Hox, отвечающих за формирование переднезадней оси тела. Таким образом, теория «первичной личинки» подразумевает массивную конвергенцию (сходные изменения, происходящие параллельно в разных филогенетических группах) в регуляции этих генов у независимо эволюционировавших линий бентосных билатерально-симметричных животных (рис. 2, слева).
1,
2,
3
Вторая гипотеза утверждает, что первые многоклеточные организмы были похожи на животных с взрослым планом строения, например, плоских червей: обладали двусторонней симметрией, обитали на дне водоёмов и развивались без метаморфоза. Впоследствии, в процессе «встраивания» личиночных признаков в онтогенез предкового билатерально-симметричного животного, они дали начало формам с непрямым развитием, у которых личинки отличались по анатомическому строению от взрослых особей (рис. 2, справа). 1
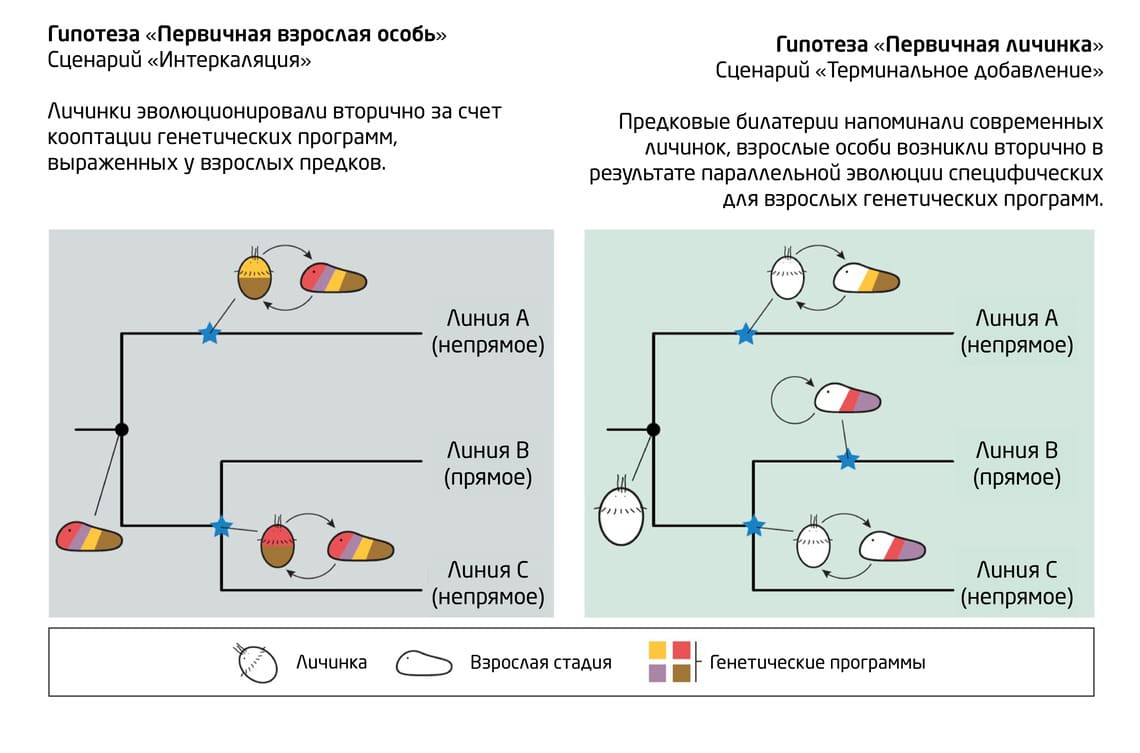 Рис. 2. Схематическая иллюстрация двух основных гипотез происхождения билатерально-симметричных животных: гипотеза «первичной личинки» (слева) и гипотеза первичной «взрослой» особи с двусторонней симметрией тела (справа).
1,
6
Рис. 2. Схематическая иллюстрация двух основных гипотез происхождения билатерально-симметричных животных: гипотеза «первичной личинки» (слева) и гипотеза первичной «взрослой» особи с двусторонней симметрией тела (справа).
1,
6
Животные, у которых наблюдается переход от радиальной к двусторонней симметрии тела в процессе онтогенеза, вызывают особый интерес у учёных. Например, у первичноротых животных, представителей клады Spiralia, к которым относятся кольчатые черви (аннелиды), моллюски и плоские черви, спиральное дробление сначала приводит к спиралевидному расположению бластомеров (рис. 3). В результате плавающие личинки этих животных – трохофоры – исходно обладают вращательной (спиральной) симметрией.
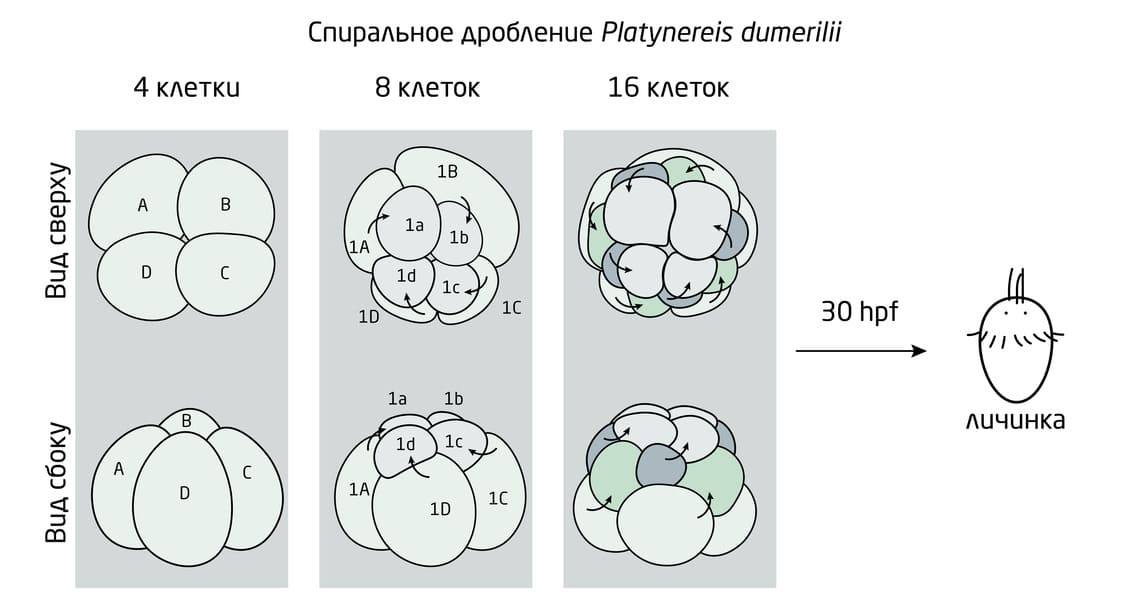 Рис. 3. Схема спирального дробления представителей клады Spiralia.
Рис. 3. Схема спирального дробления представителей клады Spiralia.
Однако, начиная с личиночных стадий, незадолго до метаморфоза личинки приобретают элементы билатеральной симметрии и постепенно превращаются в полностью билатеральных ювенильных особей. При этом направление, или «закрученность», дробления является генетически-детерминированным, т.е. строго «контролируется» генами материнской особи, в отличие от более высокоорганизованных животных, в том числе позвоночных, у которых траектория развития клеток зависит от сигналов, получаемых от микроокружения.
Это подтолкнуло учёных к мысли о том, что спиральный тип дробления является предковым механизмом, предшествовавшим эволюции билатеральных животных. Выявление генетических механизмов, лежащих в основе этого перехода, может помочь нам приблизиться к ответу на вопрос, как эволюционировал метаморфоз, как выглядели предки современных двустороннесимметричных животных и, наконец, кто был «первым» в эволюции – планктонная личинка со спиральной симметрией или бентосная двусторонне-симметричная особь. 2, 3
Поскольку именно в процессе метаморфоза происходит переход от радиальной к двусторонней симметрии, личиночные стадии развития – это «удобные» и интересные модели для изучения эволюции животных. Одним из модельных организмов являются митрарии, планктотрофные личинки морских многощетинковых червей овениид (семейство Oweniidae), родственных аннелидам. 2, 3, 4, 5, 6, 7 Интерес к этим организмам связан с их необычным строением и метаморфозом (рис. 4).
С одной стороны, некоторые анатомические характеристики митрарий, такие как строение ресничного аппарата и нервной системы (увеличенная предротовая область и пучок задних щетинок, пара нефридиев и моноцилиарную ресничная полоса, а также интраэпителиальная нервная система) схожи с таковым у личинок животных филогенетически отдалённых групп – вторичноротых (иглокожих и полухордовых), – в то время как эмбриональное развитие личинок имеет общие черты с первичноротыми животными – предками аннелид.
Ещё одной отличительной особенностью митрарий является то, что их апикальный сенсорный орган в процессе метаморфоза становится частью нервной системы взрослой особи, в то время как более простой апикальный орган трохофор дегенерирует во время метаморфоза. 5, 8 Этот орган включает апикальный пучок ресничек и базальное нервное сплетение, которое иннервируется сенсорно-нейросекреторными клетками апикальной пластинки. Он присутствовали у последних общих предков книдарий (стрекающих), сохранивших радиальную симметрию, и билатерий, а его функцией предположительно был контроль метаморфоза, в процессе которого клетки апикальной пластинки мигрировали к апикальному органу. 8
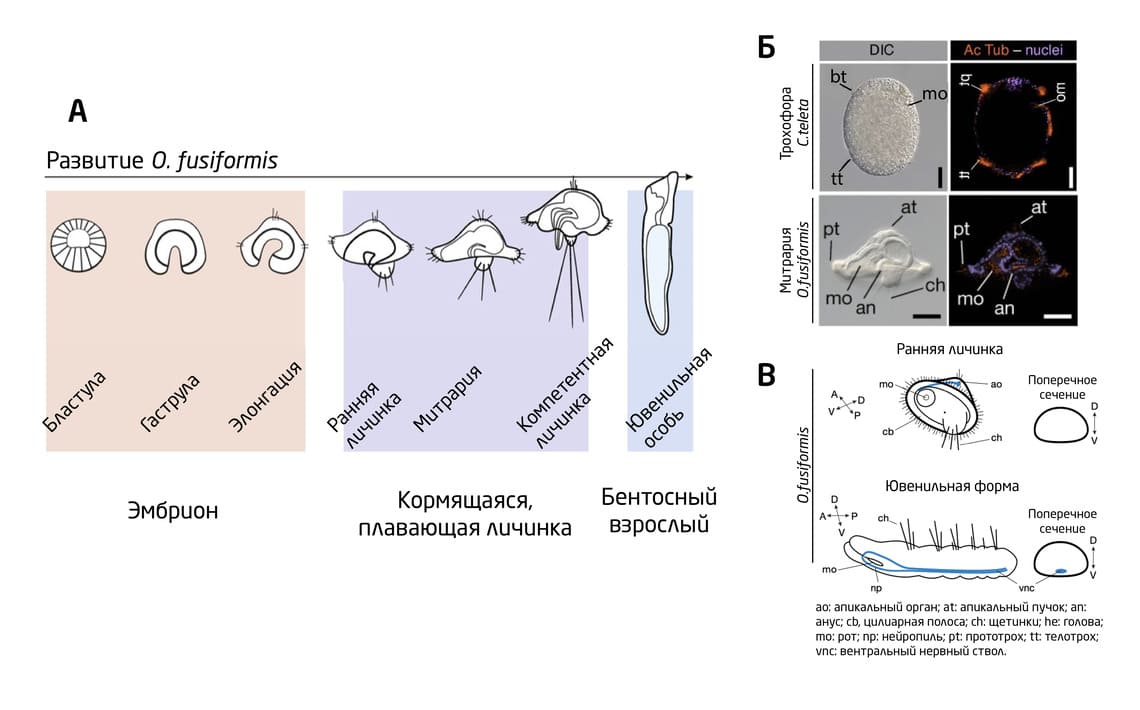 Рис. 4. (А) Схема развития O. fusiformis в 3 стадии: эмбрион, личинка, взрослая особь. (Б) Изображения трохофорной личинки C. teleta, полученные с помощью дифференциального интерференционно-контрастного метода (DIC), а также конфокального микроскопа (z-стэки). Окраска: DAPI и ацетилированный α-тубулин. (В) Схема центральной нервной системы O. fusiformis.
6,
4
Рис. 4. (А) Схема развития O. fusiformis в 3 стадии: эмбрион, личинка, взрослая особь. (Б) Изображения трохофорной личинки C. teleta, полученные с помощью дифференциального интерференционно-контрастного метода (DIC), а также конфокального микроскопа (z-стэки). Окраска: DAPI и ацетилированный α-тубулин. (В) Схема центральной нервной системы O. fusiformis.
6,
4
Благодаря этим особенностям, а также в целом простоте работы с овениидами (которые в большом количестве встречаются в приливной зоне, а личинки легко культивируются в лабораторных условиях), они стали привлекательным объектом для молекулярных исследований и изучения эмбрионального развития. Именно этих беспозвоночных – Owenia fusiformis (O. fusiformis) – учёные из Лондонского университета королевы Марии решили использовать для изучения генетических механизмов метаморфоза личинок аннелид, их эволюции и транскрипционных изменений, которые лежат в основе жизненных циклов этих беспозвоночных. 6
Методы и результаты исследования
Как и во всех молекулярно-генетических исследованиях эволюции организмов перед учёными стояла задача проанализировать геном изучаемых животных. Для этого исследователи выделили отдельные клетки, а затем с помощью методов проточной цитометрии и секвенирования оценили гаплоидный хромосомный набор O. fusiformis.
Геном овениид оказался довольно консервативным: в процессе эволюции у них происходило гораздо меньше приобретений и потерь семейств генов и сохранилось намного больше предковых ортогрупп (гомологичных генов, которые разошлись в процессе видообразования) многоклеточных животных, чем у других кольчатых червей (97.5%). У O. fusiformis был даже обнаружен ортолог гена chordin, кодирующего ингибитор морфогенетического белка кости. Этот белок участвует в определении дорсовентральной симметрии тела. Он отсутствует у других аннелид, но экспрессируется вокруг бластопора гаструлы и рта личинки O. fusiformis (рис. 5).
Примечательно, что механизм слияния хромосом у O. fusiformis был схож с таковым у моллюсков и немертин. При этом у них наблюдалось меньше клонально-специфических хромосомных перестроек, чем у других кольчатых червей. Таким образом, у O. fusiformis сохранилось большинство генетичских характеристик предковых линий, что ещё раз подтверждает целесообразность использования этих животных в качестве модельного объекта для изучения эволюции Spiralia в целом и аннелид в частности.
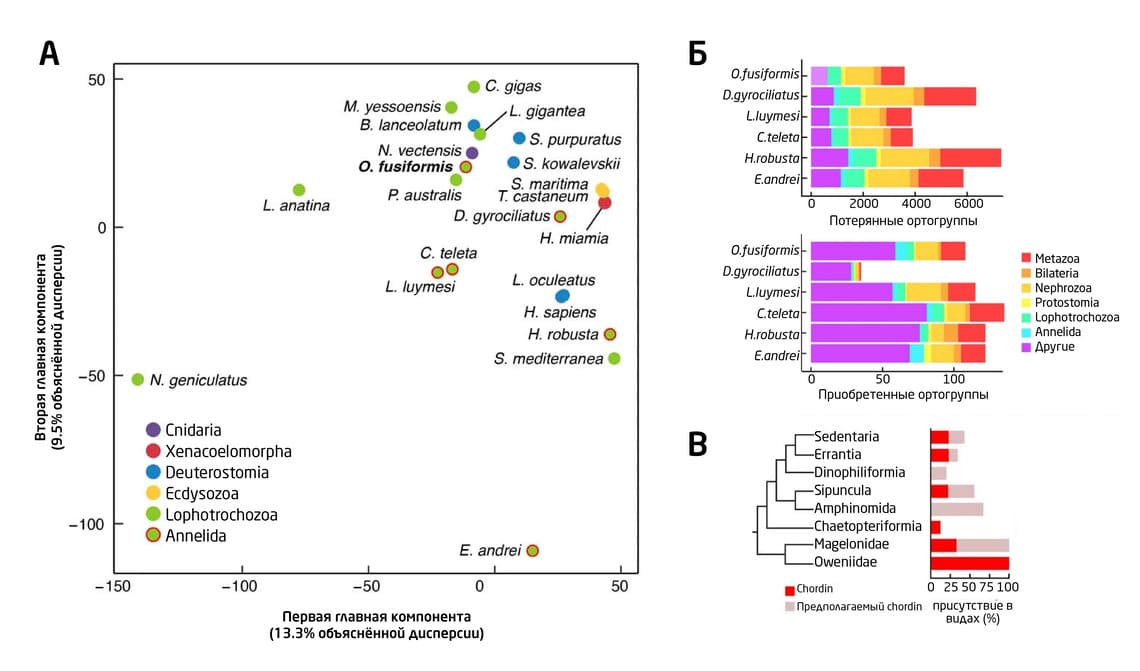 Рис. 5. (А) Анализ набора генов O. fusiformis и других многоклеточных методом главных компонент. Кластеры генов O. fusiformis. O. fusiformis имеет меньшее количество изменений и сохраняет больше предковых ортогрупп, чем другие аннелиды. (Б) O. fusiformis имеет меньшее количество потерь генов среди исследованных аннелид и меньший перенос генов после D. Gyrociliatus, имеющих самый маленький геном. (В) Краткое филогенетическое дерево присутствия и отсутствия хордина (красный) и предполагаемого хордина (светло-коричневый) у аннелид.
6
Рис. 5. (А) Анализ набора генов O. fusiformis и других многоклеточных методом главных компонент. Кластеры генов O. fusiformis. O. fusiformis имеет меньшее количество изменений и сохраняет больше предковых ортогрупп, чем другие аннелиды. (Б) O. fusiformis имеет меньшее количество потерь генов среди исследованных аннелид и меньший перенос генов после D. Gyrociliatus, имеющих самый маленький геном. (В) Краткое филогенетическое дерево присутствия и отсутствия хордина (красный) и предполагаемого хордина (светло-коричневый) у аннелид.
6
Чтобы выявить транскрипционные изменения, которые происходят в процессе метаморфоза, исследователи сравнили транскриптомы 3-х представителей аннелид – O. fusiformis и C. teleta с непрямым развитием, планктотрофными (питающимися планктоном) и лецитотрофными (питающимися желтком) личинками, соответственно, и Dimorphilus gyrociliatus (D. gyrociliatus) с прямым развитием на стадиях эмбриона, компетентными (готовыми к метаморфозу) личинками и ювенильными особями.
Для этого учёные выделили РНК и провели транскриптомный анализ (получение библиотек РНК) на 14 стадиях развития:
- ооцит;
- зигота;
- стадии 2, 4 и 8 клеток;
- целобластула (3, 4 и 5 часов после оплодотворения);
- гаструла (9 часов после оплодотворения);
- аксиальная элонгация (13 часов);
- ранняя личинка (18 часов);
- митрария (27 часов);
- преметаморфозная компетентная личинка (3 недели после оплодотворения);
- ювенильная особь после метаморфоза.
Затем гены изучаемых особей сравнили с геномом других многоклеточных животных, чтобы определить генетические приросты и потери в ходе эволюции и выявить ортологичные семейства генов. Сайты связывания транскрипционных факторов определяли с помощью метода ATAC-seq (Assay for Transposase-Accessible Chromatin using sequencing) (рис. 6).
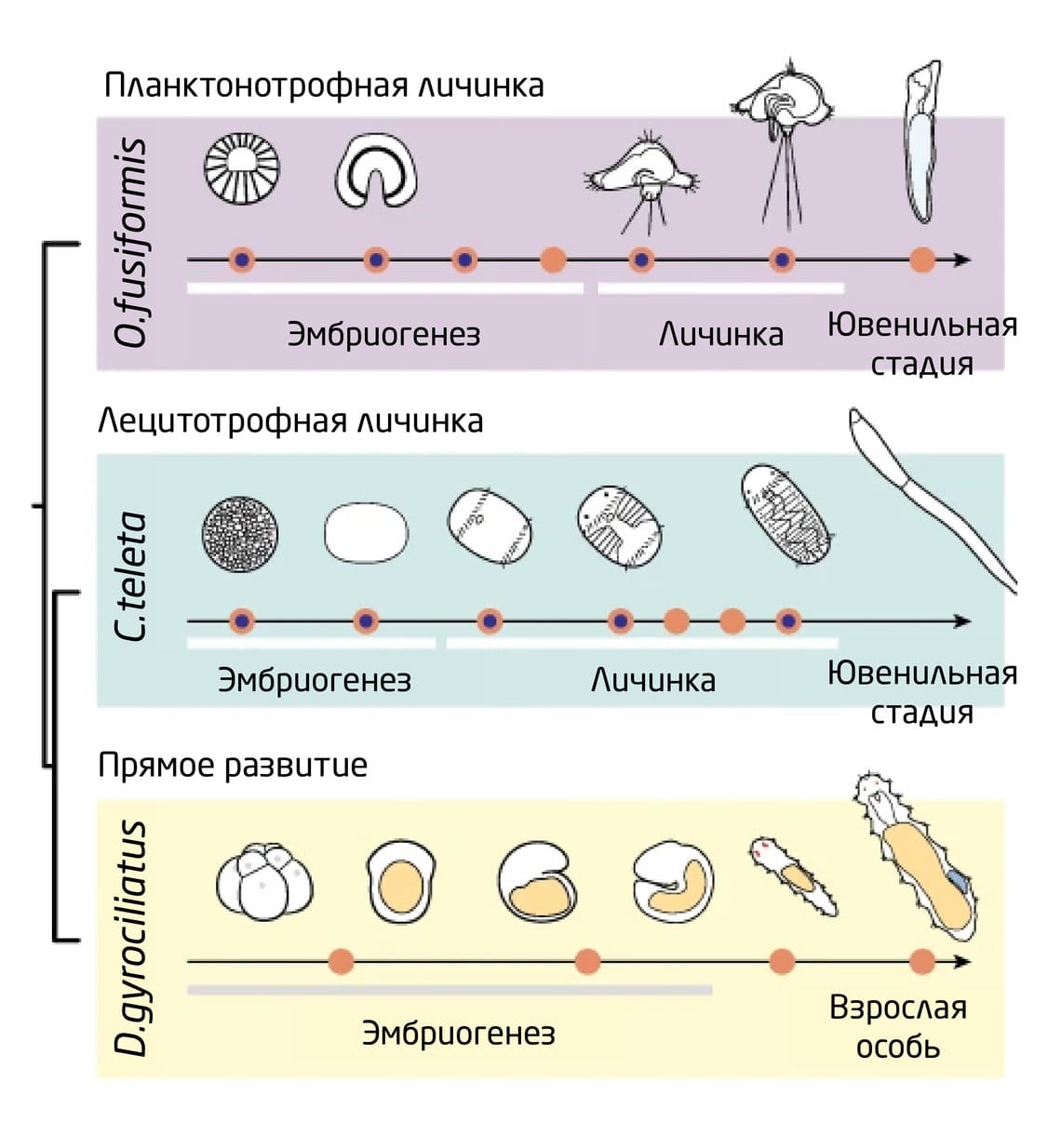 Рис. 6. Стадии развития, на которых проводили высокопроизводительное секвенирование РНК O. fusiformis, C. teleta и D. gyrociliatus (оранжевые кружки) и анализ доступного для транспозазы хроматина с помощью высокопроизводительного секвенирования (ATAC-seq; оранжевые кружки с синей точкой внутри).
6
Рис. 6. Стадии развития, на которых проводили высокопроизводительное секвенирование РНК O. fusiformis, C. teleta и D. gyrociliatus (оранжевые кружки) и анализ доступного для транспозазы хроматина с помощью высокопроизводительного секвенирования (ATAC-seq; оранжевые кружки с синей точкой внутри).
6
Как показали результаты транскриптомного анализа, на этапах раннего эмбриогенеза динамка транскрипции генов в целом не отличалась у изучаемых видов. Различия усиливались по мере «взросления» и достигали пика на личиночных стадиях, а у планктотрофных личинок ещё и на стадии взрослой особи. У O. fusiformis и C. teleta было обнаружено 12, а у D. gyrociliatus – 9 генетических кластеров, экспрессия которых строго зависела от стадии развития. Только один кластер генов демонстрировал двухфазную активацию – в период раннего эмбриогенеза и на ювенильной стадии. Эти гены были преимущественно связаны с ключевыми клеточными процессами. Гены раннего развития отвечали за процессы трансляции и метаболизма, в то время как поздние гены были связаны с клеточной коммуникацией, морфо- и органогенезом (рис. 7).
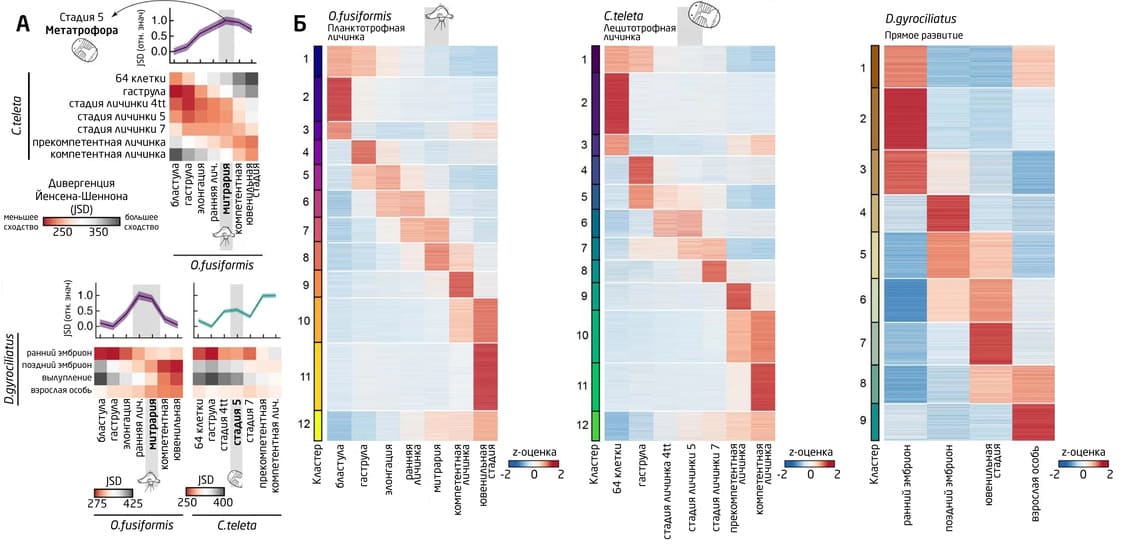 Рис. 7. (А) Тепловая карта усреднённых парных транскриптомных дивергенций Йенсена-Шеннона (JSD) между O. fusiformis и C. Teleta (наверху) и между D. gyrociliatus и O. fusiformis (внизу слева), либо C. teleta (внизу справа). (Б) Тепловая карта кластеров k-средних всех транскриптов, чья экспрессия не была нулевой хотя бы на одной из стадий развития в оптимальном количестве кластеров: 9-ти для D. gyrociliatus и 12-ти для O. fusiformis и C. teleta.
6
Рис. 7. (А) Тепловая карта усреднённых парных транскриптомных дивергенций Йенсена-Шеннона (JSD) между O. fusiformis и C. Teleta (наверху) и между D. gyrociliatus и O. fusiformis (внизу слева), либо C. teleta (внизу справа). (Б) Тепловая карта кластеров k-средних всех транскриптов, чья экспрессия не была нулевой хотя бы на одной из стадий развития в оптимальном количестве кластеров: 9-ти для D. gyrociliatus и 12-ти для O. fusiformis и C. teleta.
6
Гены раннего развития были наиболее консервативными у всех 3-х видов. В то же время транскрипционные факторы, отвечающие за формирование нервной системы (например, pax6) и мезодермы (foxF), а также участвующие в формировании переднезадней оси тела (Hox1 и Hox4; Рис. 4), у особей с непрямым развитием были активны в период взросления, на постличиночных стадиях, а у животных с прямым развитием активировались уже на этапах раннего эмбриогенеза. При этом у животных с лецитотрофными личинками C. teleta пик экспрессии этих факторов был раньше, чем у O. fusiformis. Временной сдвиг в активации у O. fusiformis относительно C. teleta также был обнаружен для генов ферментов и структурных белков, что может отражать различия в анатомии личинок.
 Рис. 8. Изображения конфокальной микроскопии, иллюстрирующие экспрессию генов Hox (метод гибридизации in situ) на стадиях митрарии, предкомпетентной личинки и ювенильной особи O. fusiformis. Hox3 – единственный ген, который экспрессируется на стадии митрарии (белая стрелка). На стадии предкомпетентной личинки (белые стрелки) и ювенильной особи экспрессия генов Hox происходит вдоль переднезадней оси формирующегося туловища. Соединение головы и туловища на ювенильной стадии обозначено чёрными стрелками. сs – щетинки (chaetal sack); mg – средняя кишка, mo – рот. Разрешение: 50 µm (личиночные стадии) или 100 µm (ювенильная стадия).
6
Рис. 8. Изображения конфокальной микроскопии, иллюстрирующие экспрессию генов Hox (метод гибридизации in situ) на стадиях митрарии, предкомпетентной личинки и ювенильной особи O. fusiformis. Hox3 – единственный ген, который экспрессируется на стадии митрарии (белая стрелка). На стадии предкомпетентной личинки (белые стрелки) и ювенильной особи экспрессия генов Hox происходит вдоль переднезадней оси формирующегося туловища. Соединение головы и туловища на ювенильной стадии обозначено чёрными стрелками. сs – щетинки (chaetal sack); mg – средняя кишка, mo – рот. Разрешение: 50 µm (личиночные стадии) или 100 µm (ювенильная стадия).
6
Развитие туловища и гетерохрония регуляции генов Hox
У всех 3-х видов, O. fusiformis, C. teleta и D. gyrociliatus, древние гены многоклеточных животных Metazoa активировались в ранние периоды развития. Эволюционно молодые видоспецифичные гены у O. fusiformis и D. gyrociliatus, наоборот, более активно экспрессировались на компетентных и ювенильных стадиях, а у C. teleta – на стадиях бластулы и гаструлы (рис. 9). Эти результаты позволяют предположить, что именно эволюционно новые гены сыграли ключевую роль в развитии признаков личинок кольчатых червей, характерных для конкретной линии.
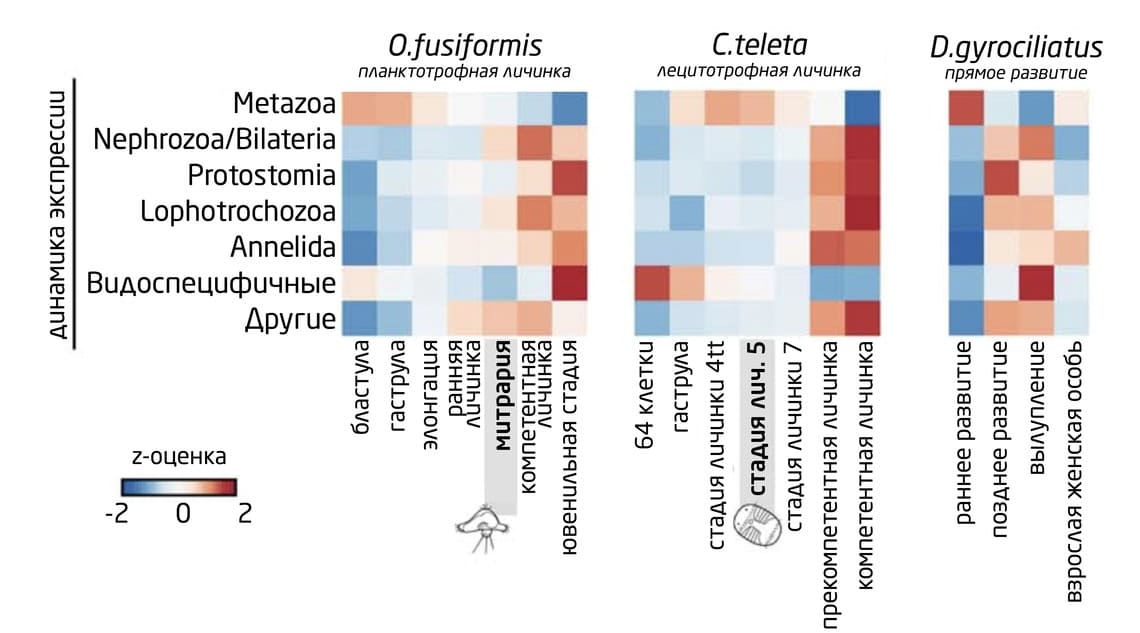 Рис. 9. Динамика экспрессии каждого набора генов на разных стадиях развития 3-х аннелид.
6
Рис. 9. Динамика экспрессии каждого набора генов на разных стадиях развития 3-х аннелид.
6
Наибольшее сходство в транскрипции генов у личинок O. fusiformis было обнаружено с билатеральными животными, имеющими планктотрофные подвижные личинки, а также с планулами книдарий (стрекающих) (рис. 10).
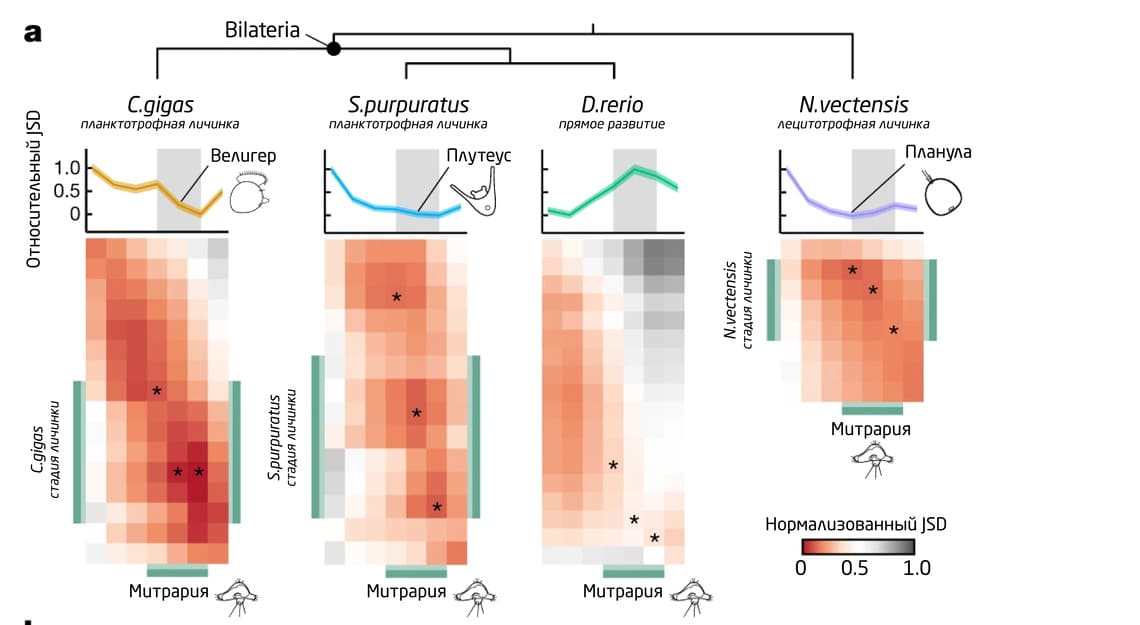 Рис. 10. Тепловые карты парных нормализованных JSD O. fusiformis и C. gigas, S. purpuratus, D. rerio и N. vectensis. Звёздочки обозначают стадии минимальной JSD каждого вида к стадии личинки O. fusiformis. Личиночные фазы выделены зелёным.
6
Рис. 10. Тепловые карты парных нормализованных JSD O. fusiformis и C. gigas, S. purpuratus, D. rerio и N. vectensis. Звёздочки обозначают стадии минимальной JSD каждого вида к стадии личинки O. fusiformis. Личиночные фазы выделены зелёным.
6
Анализ активности гомеодоменных факторов транскрипции (регуляторные белки эуариот, которые содержат консервативные ДНК-связывающие структурные мотивы или домены из 60 аминокислот (гомеодомены) и участвуют в контроле транскрипции ДНК многих важных для развития генов) показал наиболее выраженные различия между видами с прямым и непрямым развитием. В тканях взрослых особей O. fusiformis транскрипция генов, связанных с развитием органов передней части тела, была наиболее активна во время эмбриогенеза, в то время как гены задней части тела и туловища активировались на стадии митрарии и преобладали над генами передней части тела.
У O. fusiformis гены туловища и задней части тела были сконцентрированы в вентральной области и вокруг анального отверстия личинки, а их распределение и уровень экспрессии увеличивались по мере формирования туловища. Экспрессия генов передней части тела повышалась на стадии личинки и оставалась относительно стабильной в процессе всего развития. В целом у личинок планктотрофных аннелид O. fusiformis по сравнению с аннелидами с лецитотрофными личинками C. teleta и прямым развитием D. gyrociliatus формирование туловища откладывалось до более поздних преметаморфических стадий. 6
Вместе с этим у C. teleta and D. gyrociliatus гены Hox начинали экспрессироваться вдоль туловища сразу после гаструляции, а у O. fusiformis их экспрессия в переднезаднем направлении начиналась в зачатке туловища только во время роста личинки, и этот характер экспрессии сохранялся на ювенильных стадиях. Такая поздняя активация генов Hox также наблюдается и у других планктотрофных личинок, например, у морских червей подкласса эхиурид Urechis unicinctus. Можно сказать, что она является своеобразным маркером стадий развития у различных представителей аннелид (рис. 11).
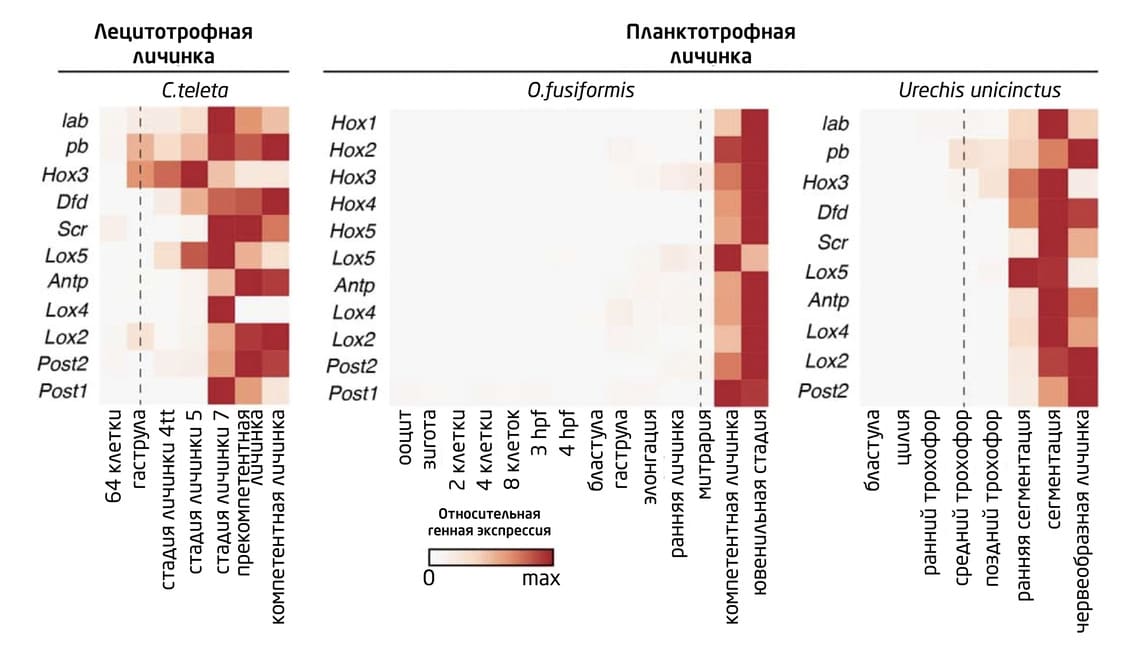 Рис. 11. Тепловые карты экспрессии гена Hox в ходе развития C. teleta, O. fusiformis и Urechis unicinctus. У 2-х видов аннелид с плактотрофной личинкой гены Hox экспрессируются на личиночной стадии, в то время как у C. teleta экспрессия наблюдается во время эмбриогенеза.
6
Рис. 11. Тепловые карты экспрессии гена Hox в ходе развития C. teleta, O. fusiformis и Urechis unicinctus. У 2-х видов аннелид с плактотрофной личинкой гены Hox экспрессируются на личиночной стадии, в то время как у C. teleta экспрессия наблюдается во время эмбриогенеза.
6
Гетерохрония – ключевой механизм в эволюции билатерально-симметричных животных
Поздняя дифференцировка туловища может быть одной из ключевых особенностей кольчатых червей. Как и у других питающихся планктоном личинок, у O. fusiformis дифференциация туловища происходит на более поздних, предметаморфозных стадиях, и преимущественно из передних эктодермальных участков, а не из боковых зачатков, как например, у кольчатых червей с лецитотрофными личинками и животных с прямым развитием (рис. 12).
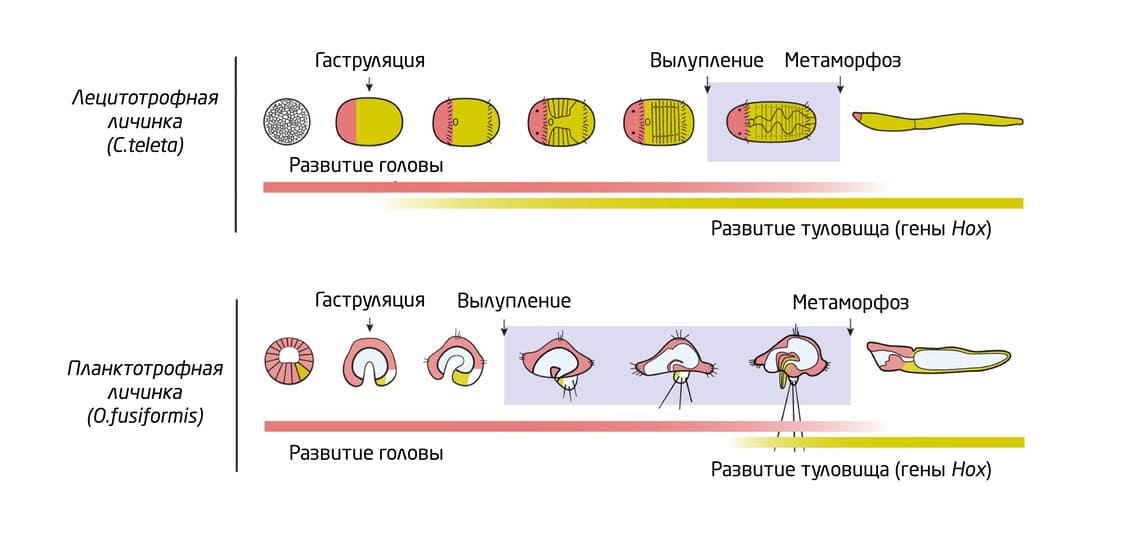 Рис. 12. Сравнение разных типов дифференцировки туловища у лецитотрофных и планктотрофных личинок.
Рис. 12. Сравнение разных типов дифференцировки туловища у лецитотрофных и планктотрофных личинок.
Задержка развития туловища до постличиночных стадий также наблюдается в филогенетически отдалённых кладах Spiralia, Ecdysozoa и Deuterostomia с «головными» личинками. У таких личинок голова развивается раньше основной оси тела, поэтому личинка достигает подвижности и может самостоятельно питаться на ранних этапах развития. У личинок, которые не питаются самостоятельно, и личинок особей с прямым развитием, как среди кольчатых червей, так и среди других представителей билатеральных животных, дифференцировка туловища начинается одновременно с или сразу после начала формирования передней части тела и головы – ещё до гаструляции. Подобная гетерохрония в развитии туловища, вероятно, и является одним из ключевых механизмов, сопровождающих эволюцию жизненных циклов. Это отличается от ранее предложенных механизмов, которые подразумевают кооптацию, т.е. приобретение новых функций, или независимую, параллельную эволюцию генов взрослых особей, способствующую кардинальному изменению жизненного цикла животного, а именно появлению личиночных стадий. 6, 9
Активная дифференцировка туловища и экспрессия генов Hox в постэмбриональном периоде может быть наиболее древней чертой билатеральных животных, которая сопровождала эволюцию метаморфоза и использование общих генетических модулей у личинок различных линий беспозвоночных (в частности, генов передней части тела). Появление таких личинок среди Bilateria может рассматриваться как специфичная для аннелид инновация, которая происходила за счёт задержки дифференцировки туловища и изменения динамики экспрессии генов Hox. Здесь нельзя исключить кооптацию генов – именно она могла способствовать появлению аналогичных типов клеток и личиночных органов у разных животных. При этом постэмбриональное начало развития туловища и активация генов Hox, вероятно, является наиболее «экономичным» предковым состоянием Bilateria, ведь личинка, обладающая сформированными органами передней части тела, начинала независимо питаться уже в самый ранний период развития (рис. 13).
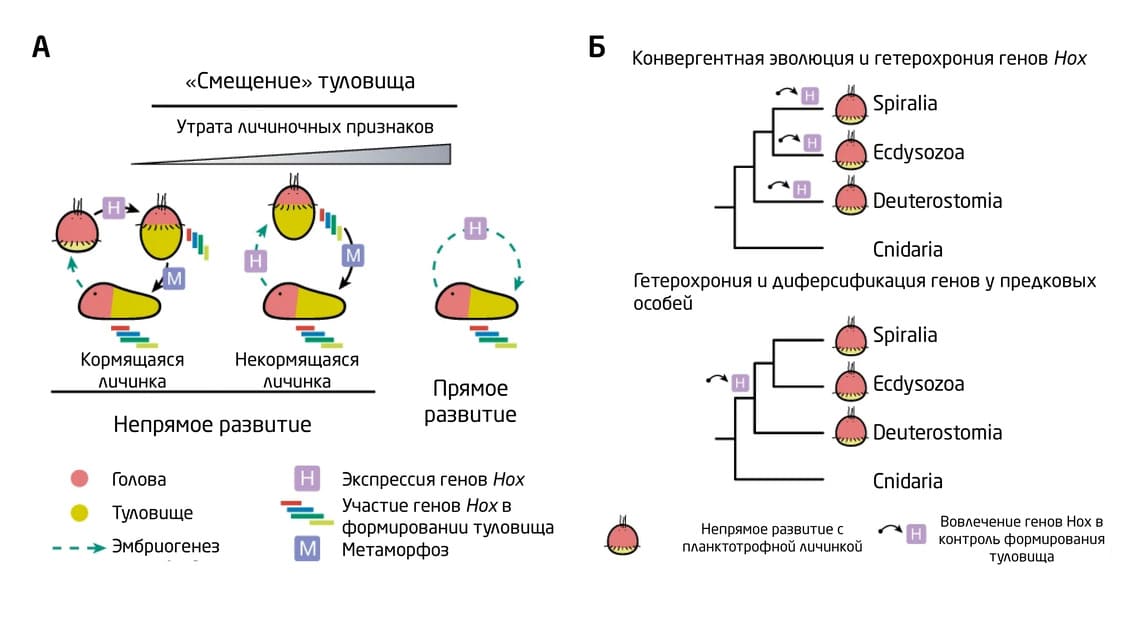 Рис. 13. (А) Схематическое изображение 3-х основных типов жизненных циклов и временные различия в экспрессии генов Hox у билатерально-симметричных животных. У особей с некормящимися (планктотрофными) личинками и животных с прямым развитием инициация транскрипции генов Hox происходит раньше, чем у особей с непрямым развитием и кормящимися (лецитотрофными) личинками. Личиночные органы редуцированы у непитающихся личинок и отсутствуют при прямом развитии. (Б) Альтернативные сценарии эволюции непрямого развития Bilateria. Сверху: в процессе конвергентной эволюции происходил временной сдвиг в экспрессии генов Hox и развитии туловища до преметаморфозных стадий. Временное расхождение в развитии вентральной части тела, головы и туловища могло способствовать независимой эволюции личинок в линиях билатерально-симметричных животных.
6
Рис. 13. (А) Схематическое изображение 3-х основных типов жизненных циклов и временные различия в экспрессии генов Hox у билатерально-симметричных животных. У особей с некормящимися (планктотрофными) личинками и животных с прямым развитием инициация транскрипции генов Hox происходит раньше, чем у особей с непрямым развитием и кормящимися (лецитотрофными) личинками. Личиночные органы редуцированы у непитающихся личинок и отсутствуют при прямом развитии. (Б) Альтернативные сценарии эволюции непрямого развития Bilateria. Сверху: в процессе конвергентной эволюции происходил временной сдвиг в экспрессии генов Hox и развитии туловища до преметаморфозных стадий. Временное расхождение в развитии вентральной части тела, головы и туловища могло способствовать независимой эволюции личинок в линиях билатерально-симметричных животных.
6
Авторы работы показали, что гетерохрония, т.е. временные сдвиги в формировании туловища, – это один из ключевых механизмов, сопровождающих эволюцию билатерально-симметричных животных в целом и определяющих разнообразие личиночных форм в частности. На это указывают отсроченное развитие туловища до преметаморфозных стадий у кормящихся личинок O. fusiformis и, наоборот, ранее начало формирования туловища – сразу после гаструляции – у некормящихся личинок C. teleta с постепенным метаморфозом и на стадии эмбриогенеза у D. gyrociliatus с прямым развитием.
У эмбриона O. fusiformis увеличенная передняя область даёт начало тканям будущей личинки и головы взрослой особи. Это черта характерна для других «головных» личинок билатерально-симметричных животных, с которыми O. fusiformis демонстрирует удивительно высокое сходство в ходе транскрипции. На основании результатов исследования можно сделать вывод, что решающую роль в приобретении двусторонней симметрии у исходно радиально-симметричных представителей клады Spiralia сыграли сдвиги в динамике экспрессии генов, отвечающих за формирование переднезадней оси тела, и, как следствие, временное разделение процессов формирования головы и туловища, а не кооптация или появление новых генов.
Литература
1. Raff R.A. Origins of the other metazoan body plans: the evolution of larval forms. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 2008.
2. Carrillo-Baltodano A.M. et al. Early embryogenesis and organogenesis in the annelid Owenia fusiformis. EvoDevo, 2021.
3. Sly B.J. et al. Who came first–larvae or adults? origins of bilaterian metazoan larvae.The International Journal of Developmental Biology, 2003.
4. Martín-Durán J.M. et al. Convergent evolution of bilaterian nerve cords. Nature, 2018.
5. Seudre O. et al. ERK1/2 is an ancestral organising signal in spiral cleavage. Nature Communications, 2022.
6. Martín-Zamora F.M. et al. Annelid functional genomics reveal the origins of bilaterian life cycles. Nature, 2023.
7. Helm C. et al. Owenia fusiformis – a basally branching annelid suitable for studying ancestral features of annelid neural development. BMC Ecology and Evolution, 2016.
8. Marlow H. et al. Larval body patterning and apical organs are conserved in animal evolution. BMC Biology, 2014.
9. Richard R.S. Multiple origins of feeding head larvae by the Early Cambrian. Canadian Journal of Zoology, 2020.




.jpg)