Медиатека
Доставка лекарств в головной мозг: современные решения
Оглавление:
•
Почему мозг не хочет лечиться: гематоэнцефалический барьер
•
Неинвазивные способы доставки лекарств, или как обмануть собственный мозг
Масса головного мозга составляет всего 2% от общей массы тела. При этом его энергопотребление превышает 20%. Мозг окружает плотная сеть сосудов и капилляров длиной около 650 км, которая снабжает его всеми необходимыми метаболическими ресурсами. Для правильной передачи сигнала клеткам мозга — нейронам и глие — особенно важно поддерживать гомеостаз ионов, нейротрансмиттеров, нейромодуляторов и нейропептодов на определенном уровне, отличном от того, который характерен для остального кровотока. Кроме того, мозг обладает крайне ограниченными способностями к регенерации и должен быть хорошо защищен от токсичных веществ и инфекций.
Почему мозг не хочет лечиться: гематоэнцефалический барьер
Чтобы поддерживать изоляцию, даже несмотря на интенсивное кровоснабжение мозг отделён от всего остального кровотока пятью барьерами 1. Из них самый избирательный — гематоэнцефалический барьер (ГЭБ). ГЭБ работает как пункт таможни: через него свободно проходят только очень маленькие молекулы (<400 Да), к тому же неполярные (например, молекулы воды, газы) 1, 2. Все остальные вещества подвергаются пристрастному досмотру (Рис. 1).
ГЭБ преимущественно состоит из трех типов клеток: клеток эндотелия капилляров, перицитов и отростков астроцитов — основных клеток глии. Они расположены на подложке из базальной мембраны и соединены плотными межклеточными контактами (Рис. 1). Кроме того, в отличие от других органов, капилляры, снабжающие мозг, не фенестрированы, т.е. не имеют просветов, что дополнительно ограничивает прохождение молекул.
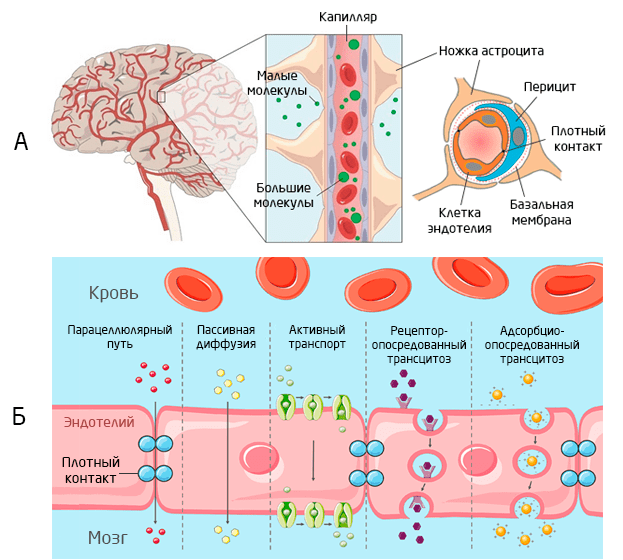
Рис. 1. Строение ГЭБ (А) Источник >>> и способы транспортировки веществ через барьер (Б) 3.
Такая структура обеспечивает высокую степень контроля за транспортом веществ в центральную нервную систему. Однако она же препятствует действию до 98% лекарств, которые должны попадать в головной мозг 1, 2. При этом болезни мозга, в частности нейродегенеративные и рак, являются одними из наиболее распространенных, тяжелых и плохо поддающихся лечению 4. Число пациентов с этими заболеваниями продолжает расти, в то время как лекарства для их лечения все еще показывают самую низкую эффективность по сравнению с другими терапевтическими методами. В связи с этим на сегодняшний день особенно остро стоит вопрос о разработке эффективных подходов доставки лекарств в мозг.
Возможные подходы к решению этой задачи делят на инвазивные и неинвазивные. Последние представляют наибольший интерес, ведь инвазивные методы требуют хирургического вмешательства и внедрения импланта, что связано с дополнительными рисками для пациента, но при этом не гарантирует излечения 1. Ниже мы рассмотрим наиболее перспективные неинвазивные пути решения этой задачи.
Неинвазивные способы доставки лекарств, или как обмануть собственный мозг
1. Химическая модификация препаратов
Один из методов доставки лекарств основан на знаниях об избирательной проницаемости ГЭБа. Действительно, если отдельные молекулы, даже крупные, все же пересекают границу, значит, можно попытаться сообразно модифицировать действующее вещество, при этом сохранив его эффективность.
Первый способ — сделать молекулу более липофильной, т.е. жирорастворимой. Такие молекулы проще проходят через клеточные мембраны, а значит и ГЭБ. Работающий по этому принципу препарат — кодеин — получают присоединением метильной группы к молекуле морфина (Рис. 2А), что увеличивает его проходимость через ГЭБ в 10 раз! 5 Аналогично работает и наркотическое вещество героин (Рис. 2Б). Однако есть и обратная сторона: липофильные молекулы не только легко попадают, но и быстро выводятся из мозга, что делает действие таких препаратов краткосрочным.
Другой вариант — модифицировать действующее вещество так, чтобы оно переправлялось через ГЭБ с помощью специальных белков-переносчиков. Например, L-допа попадает в мозг именно так. По своей структуре он напоминает фенилаланин, который транспортируется через ГЭБ с помощью аминокислотного транспортера L-типа. Такая хитрая имитация под незаменимую аминокислоту позволяет L-допа, в отличие от его конечного метаболита — дофамина, компенсировать дефицит нейромедиатора при болезни Паркинсона.
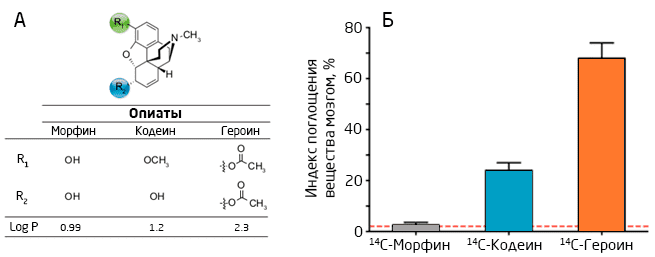
Рис. 2. Строение молекул морфина, кодеина и героина (А) и их проницаемость через ГЭБ (Б): большая проницаемость молекул кодеина и героина обусловлена наличием в них неполярных групп 5.
2. Увеличение проницаемости ГЭБа
Другой способ увеличить проницаемость ГЭБа для лекарственных препаратов — это ослабить присущую этому барьеру избирательную проницаемость. Неспецифичного увеличения проницаемости ГЭБа можно добиться за счет временного нарушения структуры клеток при применении осмотических веществ или ультразвука (Рис. 3). Направленный ультразвук в сочетании с противоопухолевыми препаратами показал высокую эффективность для терапии глиом 6 — наиболее распространенных опухолей мозга. Однако, несмотря на успехи этого направления, его нельзя назвать полностью безопасным. Неселективное увеличение проницаемости ГЭБа способствует проникновению в мозг не только лекарств, но и других потенциально опасных для мозга компонентов, например, вирусов, бактерий, токсичных метаболитов. В связи с этим, даже при кратковременном увеличении проницаемости барьера, крайне важно соотносить возможные пользу и риски для пациентов.
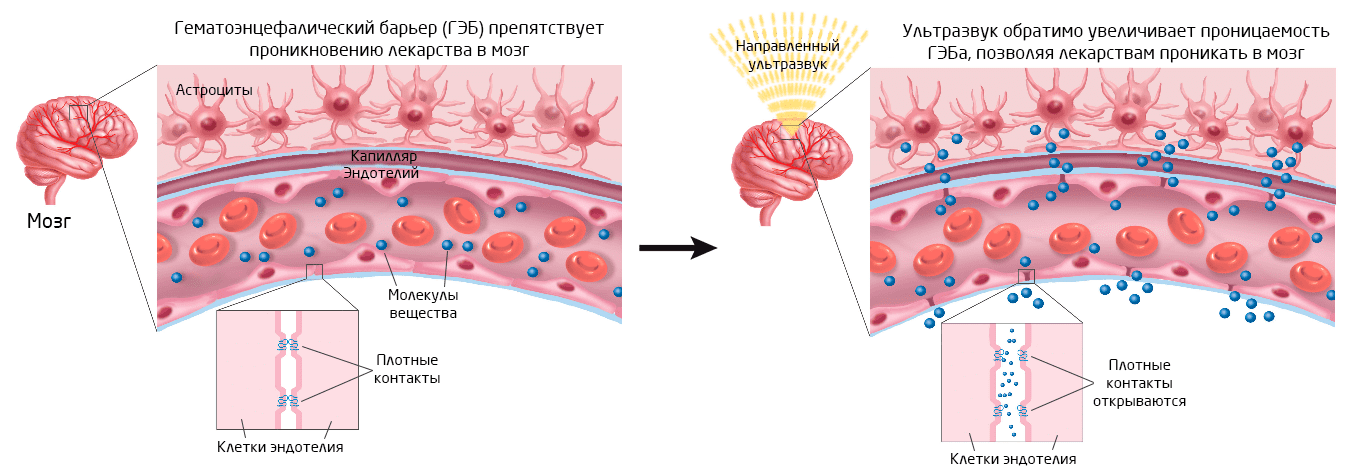
Рис. 3. Воздействие ультразвука приводит к временному нарушению плотных контактов между клетками эндотелия, что сопровождается увеличением неселективной проницаемости ГЭБа. Источник >>
3. Использование экзосом
Еще один перспективный способ доставки лекарств в мозг — использование экзосом. Экзосомы — это небольшие (30-150 нм) внеклеточные пузырьки, или везикулы (Рис. 4Г, 4Е). Их секретируют в межклеточное пространство многие клетки — как нейроны и глия, так и опухолевые 1. Поскольку экзосомы играют важную роль в межклеточных взаимодействиях и вовлечены в ряд физиологических процессов, они являются отличными кандидатами на роль транспортеров. С одной стороны, экзосомы надежно сохраняют свои грузы в кровотоке, свободно проходят гематоэнцефалический барьер и легко поглощаются клетками (Рис. 4В, 4Д), не вызывая иммунной реакции. С другой стороны, они не так быстро утилизируются фагоцитами, как искусственные доставщики, что может способствовать более длительному эффекту доставленного ими лекарственного препарата. Несмотря на все потенциальные преимущества, на сегодняшний день производство таких экзосом остается трудновыполнимой задачей, а потому этот метод пока что не используется в клинической практике.
4. Вирусные векторы
Все большую популярность сегодня набирает доставка лекарств с помощью вирусных векторов. Благодаря естественной способности заражать живые клетки вирусы отлично подходят для доставки и экспрессии «правильных» генов 2. Однако большинство вирусов в норме не проходит через ГЭБ. Чтобы увеличить проницаемость ГЭБа к вирусным векторам, исследователи либо кратковременно разрушают плотные контакты между клетками эндотелия, либо задействуют рецептор-опосредованный транспорт. Второй способ предполагает использование векторов, естественным образом пересекающих ГЭБ или их модификацию, которая позволит вирусу вступить во взаимодействие с одним из хорошо известных рецепторов межклеточного транспорта и пересечь границу 7. Наибольшего успеха в этом направлении удалось достичь, используя адено-ассоциированные вирусные векторы (Рис. 4А, 4Б). Терапия, основанная на рецептор-опосредованном транспорте векторов, уже находится на 1 фазе клинических исследований на людях. Но помимо высокой стоимости и сложности реализации, этот метод вызывает опасения ещё и в вопросах безопасности 2.
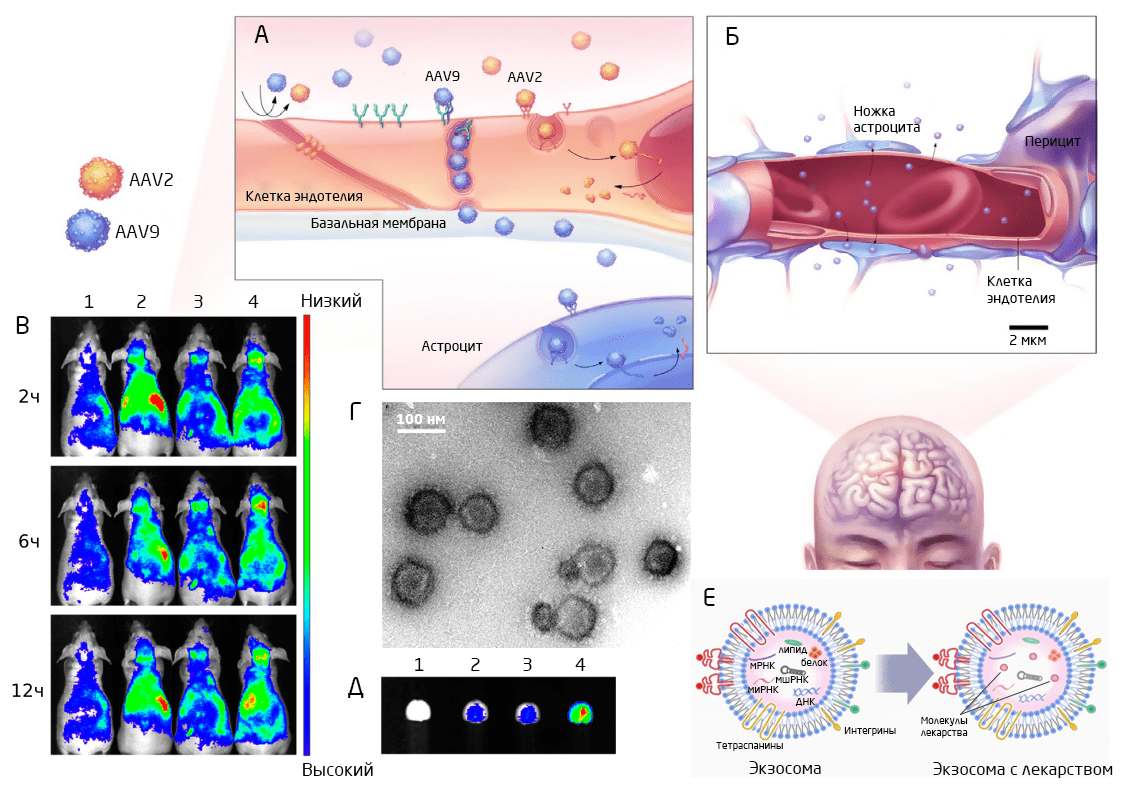
Рис. 4. Схема проникновения аденовирусных векторов (AAV2, AAV9) через ГЭБ (А,Б) 8. Накопление четырех типов экзосом (1-4) во всем теле (В) и специфично в мозге (Д) у мышей с глиомой через 2, 6, 12 часов после их введения 9. Электронная микрофотография экзосом (Г) 9 и схема строения и наполнения экзосомы действующим веществом (Е) 10.
5. Невирусные наночастицы и нанопереносчики
В последние десятилетия ведутся активные разработки по созданию наночастиц и нанопереносчиков терапевтических препаратов в мозг и другие органы. Среди них особого внимания заслуживают дендримеры и наночастицы на основе ДНК-оригами. Дендримеры представляют собой синтетические полимеры с гиперразветвленной структурой, напоминающей дерево (Рис. 5). Благодаря нанометровым размерам, легкости в управлении их физико-химическими характеристиками, а также наличию внутренних полостей дендримеры кажутся прекрасными кандидатами на роль переносчиков лекарств через ГЭБ. Однако, как и в случае с другими синтетическими компонентами, их использование вызывает вопросы относительно безопасности в долгосрочной перспективе 4.
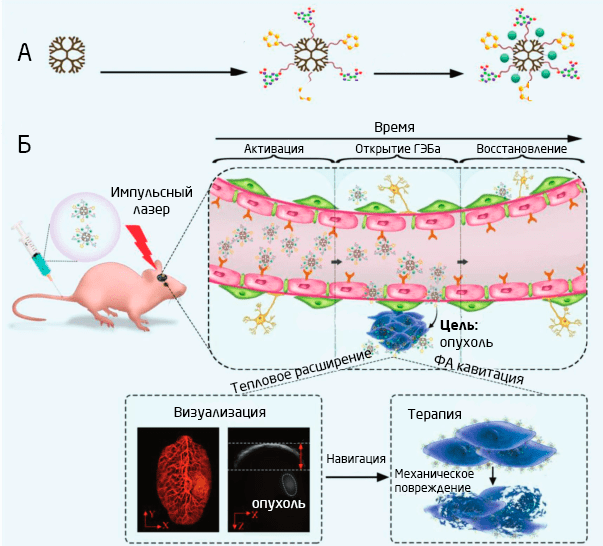
Рис. 5. Схема синтеза дендримеров (А) и иллюстрация их действия по борьбе со злокачественными опухолями (Б) 14.
Между тем, этого недостатка лишены наночастицы на основе ДНК-оригами. Они построены из привычного для любой клетки материала — ДНК — и поэтому не вызывают иммунной реакции и нейротоксичности (более подробно о технологии ДНК-оригами и ее перспективах вы можете прочитать в нашей статье). Возможность создания наночастиц самых разнообразных форм и размеров в сочетании со стабильностью ДНК-наноструктур и программируемостью доставки препарата открывает чрезвычайно широкие перспективы для их использования 11. И, хотя технология ДНК-оригами пока еще продолжает активно развиваться, впечатляющие результаты в этом направлении есть уже сейчас. В частности, наноструктуры из ДНК-оригами показали свою эффективность в противоопухолевой терапии in vivo у мышей, специфично накапливаясь в области опухолей и высвобождая противоопухолевый препарат именно в них, но не в других областях (Рис. 6А, 6Б) 11, 12. Хотя прохождение таких частиц через ГЭБ пока недостаточно изучено, есть надежда, что доставку ДНК-оригами можно будет осуществлять с помощью экзосом или направленного ультразвука 13. Способность конструкций из ДНК-оригами доставлять и высвобождать препарат при взаимодействии с заданными типами рецепторов или химическими группами предоставляет исключительно широкие возможности для создания лекарств, действующих строго по заданным мишеням.
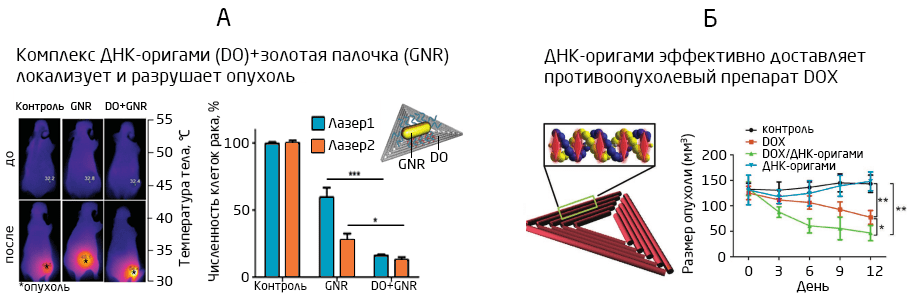
Рис. 6. ДНК-оригами в комплексе с лекарственными препаратами помогает детектировать (А) 15 и разрушать (А, Б) 11, 15 раковые клетки in vivo.
Несмотря на многочисленные исследования, разработка методов лечения болезней головного мозга была и остается сложной задачей. При этом изучение свойств ГЭБ помогает найти обходные пути для терапии нейродегенеративных расстройств и опухолей мозга. Сегодня ясно, что будущее терапии за подходами, позволяющими селективно воздействовать на определенные мишени в мозге.
Литература
1. Pandit R., Chen L., Götz J. The blood-brain barrier: Physiology and strategies for drug delivery. Advanced Drug Delivery Reviews, 2020.
2. Dong X. Current strategies for brain drug delivery. Theranostics, 2018.
3. Lombardo S.M. et al. Key for crossing the BBB with nanoparticles: The rational design. Beilstein Journal of Nanotechnology, 2020.
4. Zhu Y., Liu C., Pang Z. Dendrimer-based drug delivery systems for brain targeting. Biomolecules, 2019.
5. Mikitsh J.L., Chacko A.M. Pathways for small molecule delivery to the central nervous system across the blood-brain barrier. Perspectives in Medicinal Chemistry, 2014.
6. Luo H., Shusta E.V. Blood–brain barrier modulation to improve glioma drug delivery. Pharmaceutics, 2020.
7. Fu H., McCarty D.M. Crossing the blood–brain-barrier with viral vectors. Current Opinion in Virology, 2016.
8. Weber‐Adrian D. et al. The human brain endothelial barrier: transcytosis of AAV9, transduction by AAV2. Journal of Neurochemistry, 2017.
9. Chen C. et al. Peptide-22 and cyclic RGD functionalized liposomes for glioma targeting drug delivery overcoming BBB and BBTB. ACS Applied Materials and Interfaces, 2017.
10. Moon B., Chang S. Exosome as a Delivery Vehicle for Cancer Therapy. Cells, 2022.
11. Jiang Q. et al. Rationally designed DNA‐origami nanomaterials for drug delivery in vivo. Advanced Materials, 2019.
12. Zhang Q. et al. DNA origami as an in vivo drug delivery vehicle for cancer therapy. ACS Nano, 2014.
13. Sitta R. Novel drug targeting and delivery techniques: Avenues for the advancement of neuropharmacology. Brain Circulation, 2018.
14. Liu L. et al. Photoacoustic therapy for precise eradication of glioblastoma with a tumor site blood–brain barrier permeability upregulating nanoparticle. Advanced Functional Materials, 2019.
15. Jiang Q. et al. A self‐assembled DNA origami‐gold nanorod complex for cancer theranostics. Small, 2015.




.jpg)
























