- О компании
- Решения и приложения
-
Направления деятельности
- Интернет-магазин
-
Медиатека
СтатьиСервис

10.06.2025
Сервисная сторона лаборатории: от инсталляции оборудования до постгарантийной поддержки
Интервью со специалистами технической поддержки Компании Хеликон.
СтатьиИнтервью
27.03.2024
Интервью Анатолия Смирнова телеканалу PROБизнес
«В любой биологической лаборатории в России есть что-то от нас».
- Новости
- Мероприятия
- Партнеры
О компании
Решения и приложения
- Главная страница
- Медиатека
- Информационные статьи
- Денатурация и агрегация белков: решения и неожиданные применения: поддержка Компании Хеликон
Медиатека
Денатурация и агрегация белков: решения и неожиданные применения
Статья Андрея Черникова, студента магистерской программы «Структурная биология и биотехнология» МГУ имени М. В. Ломоносова и стипендиата Компании Хеликон.
Компания Хеликон всегда стремилась поддерживать отечественных учёных – как опытных специалистов, так и студентов, которые только делают первые шаги в науку. С этой целью мы учредили ежегодную стипендию «Хеликон» для молодых биологов со всей страны. Первыми стипендиатами стали студенты магистерской программы «Структурная биология и биотехнология», реализуемой на базе МГУ имени М.В. Ломоносова.
Мы бы хотели поделиться с вами статьёй Андрея Черникова, в которой рассказывается о борьбе с нежелательной денатурацией и агрегацией белковых структур in vitro. Андрей также задается вопросом, действительно ли агрегация — это нежелательный эффект в работе с белками.
Белки – «молекулярные машины» организма
Белки — одни из самых удивительных изобретений природы. Они задействованы в абсолютном большинстве процессов организма — от репликации ДНК до мышечных сокращений. Применение белков революционизировало некоторые области промышленности, науки и медицины. Всевозрастающий интерес к белкам ставит новые задачи перед наукой и бизнесом по повышению их эффективности и стабильности.
Строение белка — взаимное расположение структурных компонентов молекулы — определяет его функцию. К денатурации (нарушению структуры) белка могут привести различные воздействия: изменение pH, нагревание, замерзание раствора, воздействие УФ-излучения, изменение состава раствора и т.д. (Tanford, 1964). Денатурированные молекулы склонны к агрегации — слипанию, приводящему к полной потере функциональности белка (Рис. 1). Ниже описаны способы борьбы с агрегацией, ее негативные аспекты и неожиданные применения.
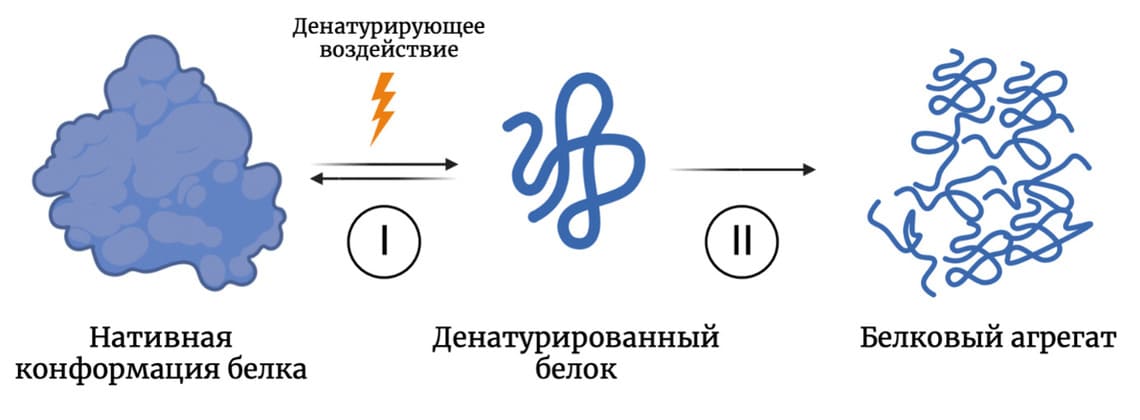
Рисунок 1. Упрощенная схема агрегации белка. Стадия I — денатурирующее воздействие, нарушающее нативную структуру белка, зачастую обратимая стадия. Стадия II — слипание денатурированных молекул белка и образование белковых агрегатов.
Противодействие денатурации и агрегации in vitro
Белки различны по стабильности. К примеру, белки термофильных бактерий остаются стабильными и функционируют при экстремальных температурах, тогда как многие белки человека стремительно денатурируют при относительно небольшом изменении условий. Подбор условий получения и хранения белков — температуры, pH, ионной силы и прочих — позволяет уменьшить потери белка, связанные с денатурацией и агрегацией.
В ходе эволюции организмы выработали собственные механизмы по противодействию денатурации и агрегации. Шапероны — это класс белков, помогающий другим белкам восстановить их структуру. Они экспрессируются при повышении температуры (Ellis et al., 1993). Низкомолекулярные вещества тоже могут успешно противодействовать различным стрессам, приводящим к денатурации и агрегации. В качестве примера можно привести накопление сорбитола белокрылками в ответ на повышение температуры (Salvucci et al., 2000). Помимо сорбитола в биотехнологии известны и активно применяются другие соединения: L-аргинин, циклодекстрин, сахароза, глицерин и прочие.
Белковая биоинженерия достигла значительных успехов в области повышения стабильности белков. Замена определенных аминокислот, направленных на более плотную упаковку гидрофобного кора, добавление дисульфидных связей, замена дестабилизирующих полярных аминокислот на поверхности белка — все это возможные методы повышения стабильности белков.
Агрегация — «абсолютное зло»?
Агрегация является большой проблемой для фармакологии, так как агрегаты могут проявлять иммуногенные свойства. Причиной ряда нейродегенеративных заболеваний (болезни Альцгеймера, болезни Хантингтона) может быть образование особых белковых агрегатов — амилоидов. В течение десятилетий внимание фармацевтических компаний и научных групп направлено на изучение этиологии данных заболеваний и возможные способы лечения.
Однако агрегация нашла очень примечательное применение. Материаловед Ли с соавторами из Технологического Университета Чэнду (Китай) смог придумать иерархически структурированный амилоидный материал (PAM), имеющий удивительно высокую химическую и термическую стабильность.
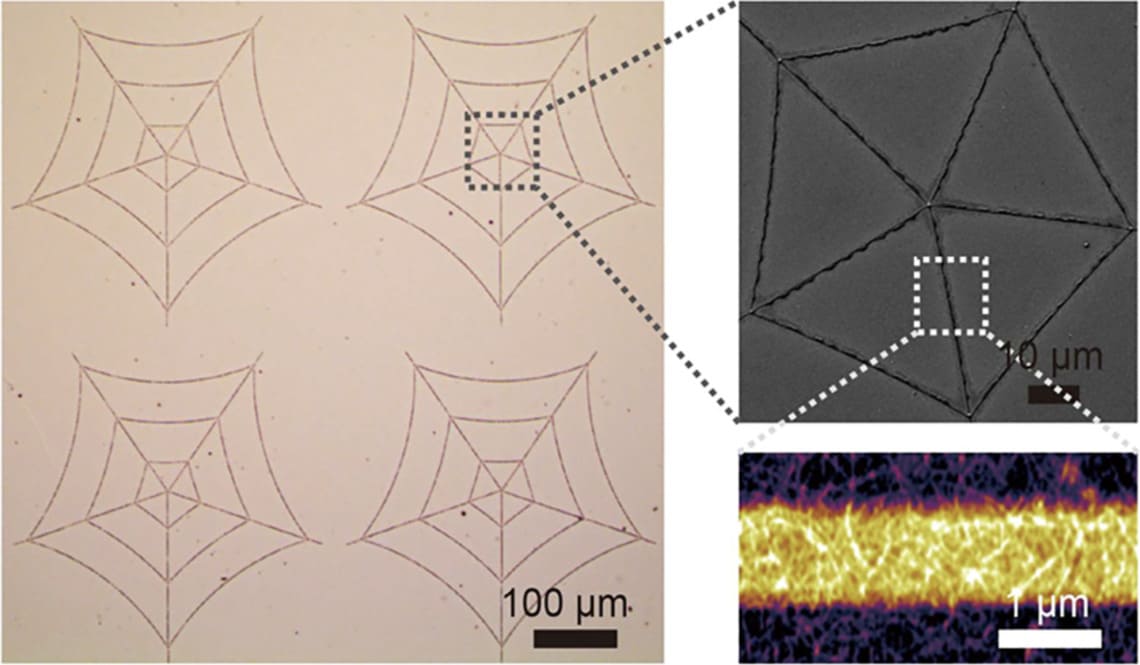
Рисунок 2. Иерархически структурированный амилоидный материал (PAM) (Li et al., 2019)
У материала есть перспективные применения, к примеру, заякоривание наночастиц или образование пористых листов для клеток (Yingfeng et al., 2019). Это лишь один из немногих примеров материала, основанного на белковых агрегатах. Хочется верить, что интересные исследования найдут свое применение в различных областях производства и медицины.
Автор: Черников Андрей
Литература
1. Ellis R. J., Laskey R. A., Lorimer G. H., Molecular Chaperones // Springer, 1993.
2. Tanford C., Protein denaturation // Advances in Protein Chemistry, 1968, 23, pp. 121-282.
3. Salvucci M. E., Dawn S., Stecher T., Henneberry J., Heat Shock Proteins in Whiteflies, an Insect That Accumulates Sorbitol in Response to Heat Stress // Journal of Thermal Biology, 2000, 25, 5, 1, pp. 363-371.
4. Li Y., Li K., Wang X., An B., Cui M., Pu J., Wei S., Xue S., Ye H., Zhao Y., Liu M., Wang Z., Zhong C., Patterned Amyloid Materials Integrating Robustness and Genetically Programmable Functionality // Nano Lett., 2019, 19, 12, pp. 8399–8408.




.jpg)