Медиатека
Анализ экспрессии микроРНК методом количественной ПЦР
Оглавление:
•
Почему стоит выбрать именно этот метод анализа?
•
Протоколы, оптимизированные для биожидкостей
1. Советы для успешного синтеза кДНК
2. Чувствительность определяется пределом обнаружения
3. Наилучшее сочетание чувствительности и специфичности
4. Валидированные ПЦР-анализы
•
Нормализация
1. Нормализация данных в qPCR с микроРНК
2. Загрязнение клетками может влиять на нормализацию
3. Выбор референсных генов
4. Проблемы, характерные для биожидкостей
•
Контроль качества результатов анализа микроРНК методом qPCR
2. Чувствительность определяется пределом обнаружения
3. Наилучшее сочетание чувствительности и специфичности
4. Валидированные ПЦР-анализы
2. Загрязнение клетками может влиять на нормализацию
3. Выбор референсных генов
4. Проблемы, характерные для биожидкостей
Почему стоит выбрать именно этот метод анализа?
В работе с микроРНК широко используется количественная ПЦР (qPCR, quantitative PCR). Несмотря на то, что метод применим только для изучения известных мишеней, у него немало достоинств, среди которых быстрота, чувствительность, невысокая цена и лёгкость выполнения анализов. Ключевым преимуществом qPCR при исследовании биологических жидкостей является то, что для постановки реакции достаточно минимального количества исходной РНК. При помощи qPCR можно проводить скрининг и профилирование микроРНК, а также проверять результаты NGS и функциональных исследований.
Протоколы, оптимизированные для биожидкостей
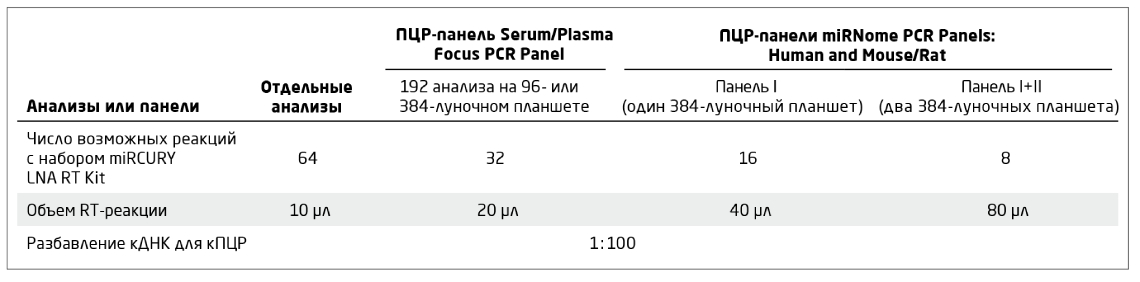
QIAGEN предлагает новые технологии для проведения полного анализа методом qPCR с обратной транскрипцией (RT-qPCR, reverse transcription qPCR) и NGS, включая технологию c использованием «закрытых» нуклеиновых кислот (LNA, locked nucleic acid). В системе miRCURY LNA miRNA PCR System каждый шаг процедуры обработки образцов биожидкостей оптимизирован для усиления сигнала и минимизации влияния ингибиторов. Более подробная информация представлена в Таблице 1 и в руководстве «miRCURY LNA miRNA PCR – Exosomes, Serum/Plasma and Other Biofluid Samples».
Таблица 1. Параметры эксперимента для образцов сыворотки/плазмы при использовании системы miRCURY LNA miRNA PCR System.
1. Советы для успешного синтеза кДНК
- Не сравнивайте образцы, приготовленные с использованием различных методов выделения РНК.
- Добавляйте шпильки РНК (входят в набор RNA Spike-In Kit) во время выделения РНК и синтеза кДНК для дальнейшей оценки качества РНК.
- Проводите выделение РНК и реакции, предшествующие ПЦР в реальном времени, не в том же помещении, где идёт ПЦР, чтобы не загрязнять кДНК ампликонами.
- Не используйте пробирки для забора крови с гепарином, так как гепарин – сильный ингибитор всех ферментативных процессов.
Для минимизации влияния небольших различий между образцами по содержанию в них ингибиторов рекомендуется увеличить объём RT-реакции. Если содержание раствора РНК в ней превышает 20%, контролируйте образцы на наличие признаков ингибирования, как описано в разделе «Базовый контроль качества: стандарты для сыворотки и плазмы крови человека».
Разбавление RT-реакции перед ПЦР – стандартная процедура в протоколе miRCURY LNA miRNA PCR. За счёт большего объема RT-реакции, используемого для образцов биологических жидкостей, коэффициент разбавления кДНК снижен по сравнению со стандартными образцами (Таблица 1). На Рис. 1 показана высокая воспроизводимость, которая может быть достигнута для RT-реакций с использованием сывороточной РНК в объемах, указанных в Таблице 1. Все последующие манипуляции и условия ПЦР соответствуют процедурам, описанным в руководстве «miRCURY LNA miRNA PCR – Exosomes, Serum/Plasma and Other Biofluid Samples Handbook».
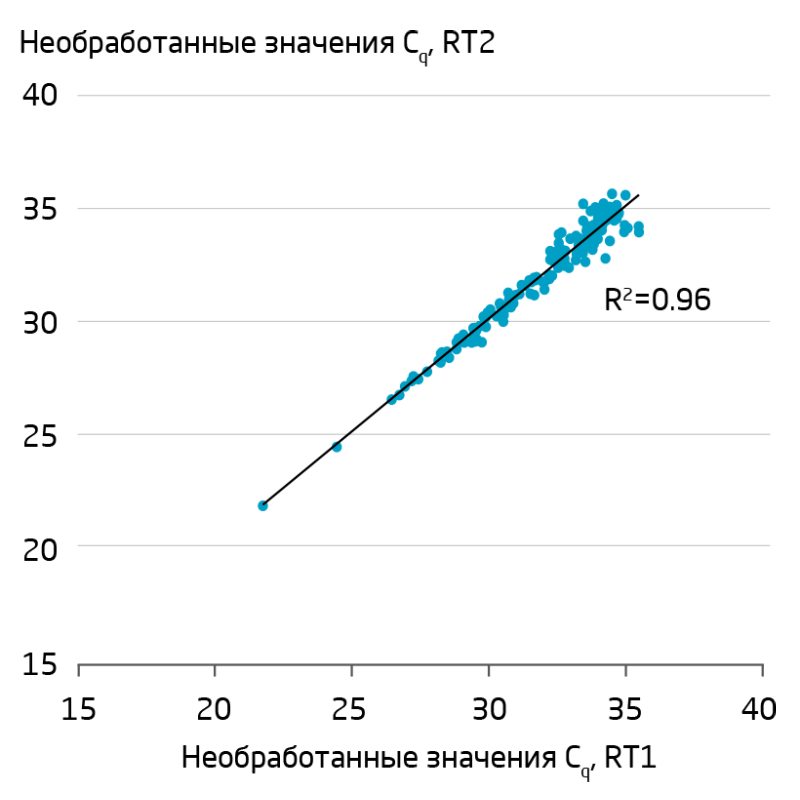
Рис. 1. Отличная воспроизводимость для технических повторов на сыворотке крови при использовании системы miRCURY LNA miRNA PCR System. Показаны необработанные значения Cq двух отдельных реакций RT (RT1 и RT2) на общей РНК, выделенной из 65 мкл сыворотки. Всего профилировано 730 микроРНК. Включены только микроРНК со значениями Cq ниже 35 (133 точки данных).
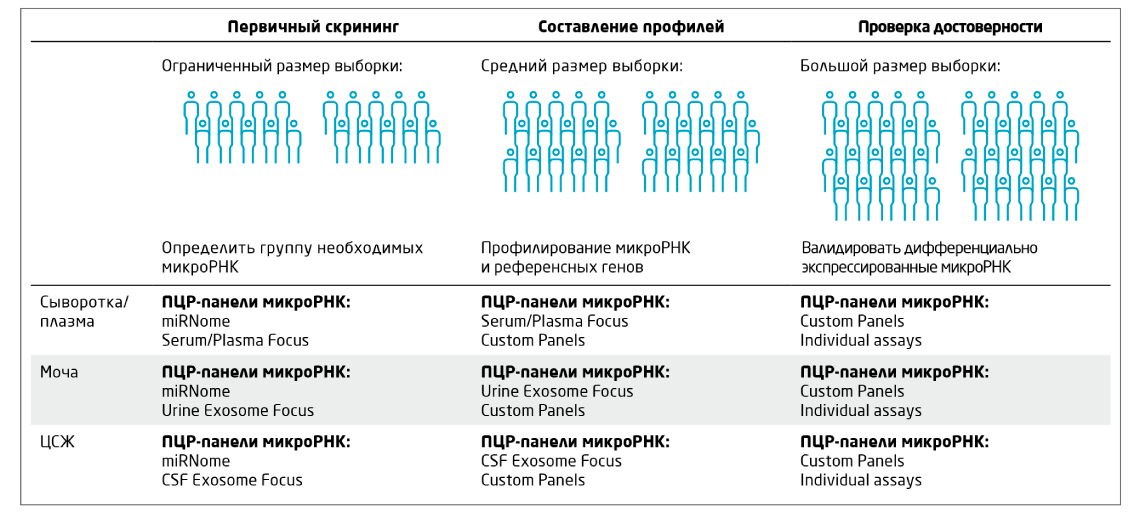
Обзор доступных ПЦР-панелей miRCURY LNA miRNA для профилирования микроРНК в биожидкостях представлен в Таблице 2. Первоначальный скрининг можно провести с помощью ПЦР-панелей miRNome, содержащих 752 хорошо охарактеризованных микроРНК. Полный miRNome-скрининг часто проводят методом NGS с последующей проверкой ПЦР с использованием пользовательских ПЦР-панелей и анализов. Узконаправленное профилирование микроРНК из биожидкостей или экзосом можно проводить непосредственно с помощью заранее разработанных фокусных ПЦР-панелей.
Таблица 2. Обзор ПЦР-панелей miRCURY LNA miRNA для профилирования микроРНК в биожидкостях. Пользовательские ПЦР-панели можно полностью адаптировать для включения любого ПЦР-анализа miRCURY LNA miRNA Assay. Валидация первоначальных результатов NGS или ПЦР-скрининга может быть выполнена с использованием заказных ПЦР-панелей или отдельных анализов.
2. Чувствительность определяется пределом обнаружения
Поскольку в бесклеточных биожидкостях содержится очень мало РНК, важно использовать высокочувствительную систему детекции. Распространено заблуждение, что более низкие значения Cq в анализах qPCR связаны с более высокой чувствительностью. На самом деле, значение Cq необходимо сравнивать либо со значением Cq в другом образце (для расчета относительной экспрессии), либо со стандартной кривой на основе анализа известных количеств мишени (для абсолютного количественного определения). Кроме того, любое значение Cq следует сравнивать со значением Cq, полученным без мишени (то есть с фоновым сигналом) и определённым с помощью контрольных реакций RT и ПЦР.
Для определения истинной чувствительности qPCR-анализа необходимо выполнить серию разведений с известным количеством исходного материала, включая отрицательный контроль (например, с заменой биожидкости водой). Предел обнаружения обычно определяют как последнюю точку в пределах линейного диапазона. Пример серии разведений, используемой для сравнения чувствительности различных qPCR-анализов, показан на Рис. 2.
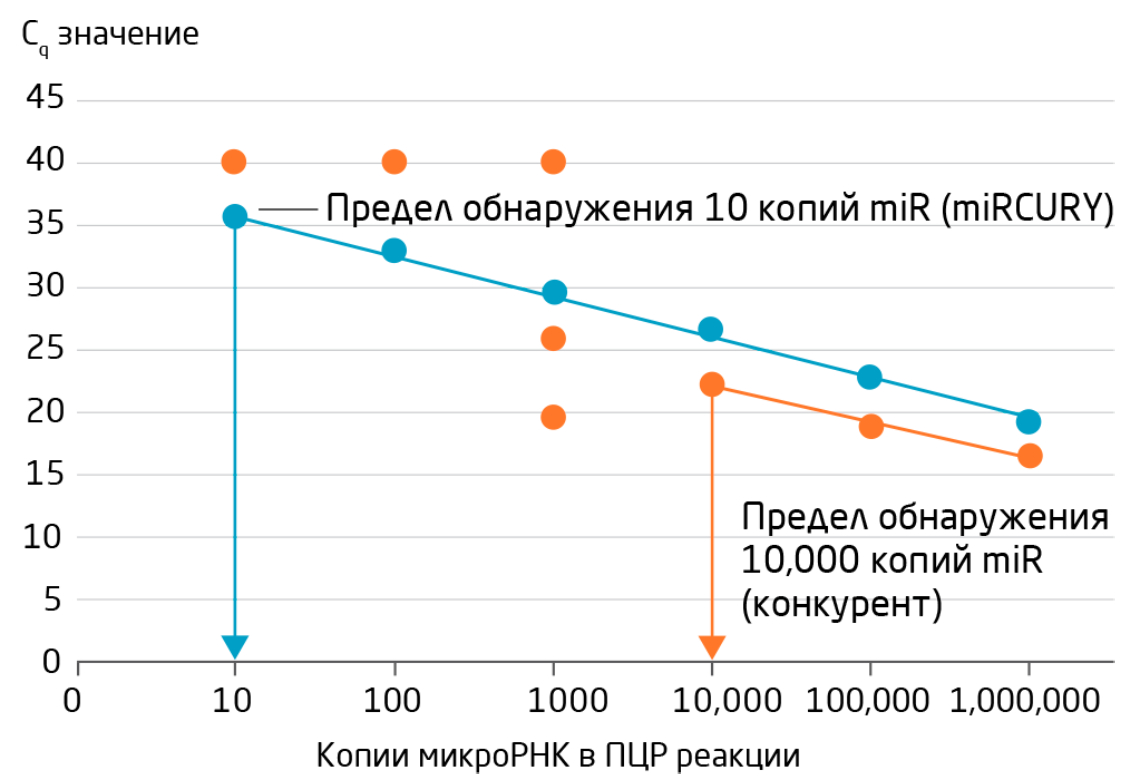
Рис. 2. Чувствительность определяется пределом обнаружения, а не значением Cq. Чувствительность ПЦР-анализов микроРНК сравнивали, используя для определения предела обнаружения серию разведений синтетической матрицы микроРНК. При использовании серии разведений hsa-let-7a значения Cq, полученные в ПЦР-анализе микроРНК конкурентным методом ниже, чем в ПЦР-анализе miRCURY LNA miRNA PCR Assay. Однако анализ конкурентным методом менее чувствителен, чем анализ miRCURY, поскольку кривая линейной регрессии для серии разведений достигает лишь 10 000, а не 10 копий.
3. Наилучшее сочетание чувствительности и специфичности
В образцах биожидкостей могут содержаться фрагменты или продукты деградации РНК других видов, поэтому необходим высокоспецифичный метод различения микроРНК и загрязняющих фрагментов. Точное количественное определение микроРНК требует линейной зависимости между сигналом и концентрацией образца. При сравнении с другими системами профилирования микроРНК miRCURY LNA miRNA PCR System оказалась единственной, которая обеспечила как высокую чувствительность, так и высокую специфичность. Это было продемонстрировано в miRQC – крупнейшем сравнительном исследовании сравнении платформ профилирования микроРНК, опубликованном в журнале Nature Methods 1.
4. Валидированные ПЦР-анализы
Более 1200 ПЦР-анализов, доступных в системе miRCURY LNA miRNA PCR System, проверяли в лабораторных условиях, чтобы убедиться в их соответствии строгим критериям эффективности. Более 95 % анализов показали уровень чувствительности менее 10 копий РНК в ПЦР-реакции (Рис. 3).
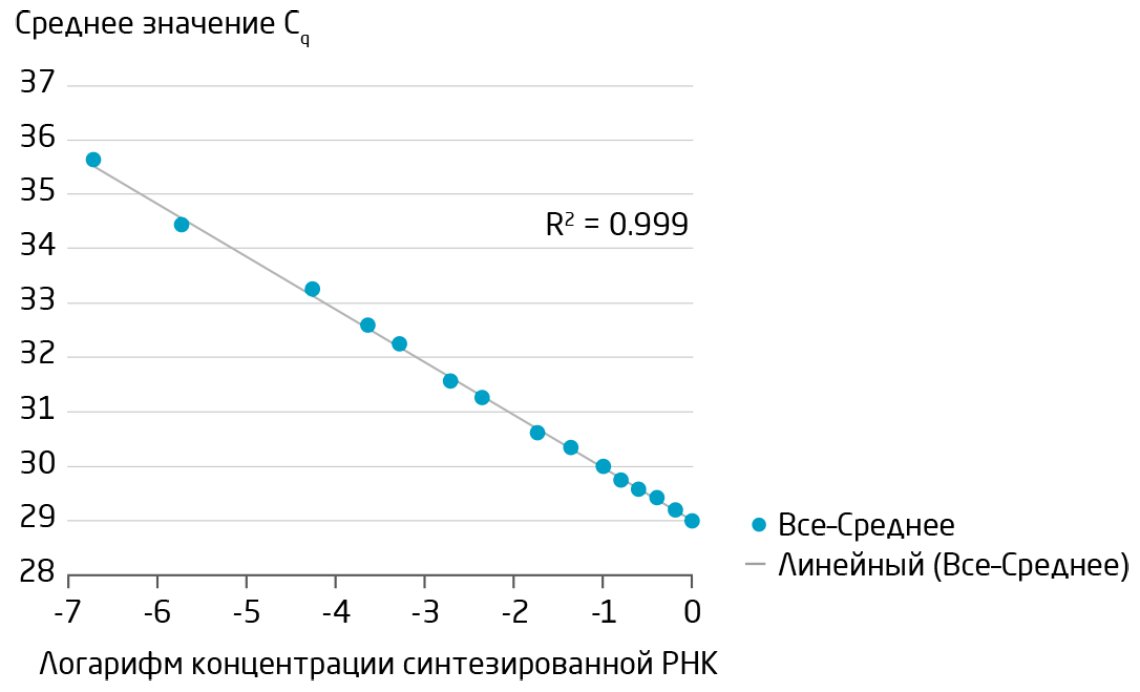
Рис. 3. ПЦР-анализ miRCURY LNA miRNA демонстрирует линейность и превосходную чувствительность в широком диапазоне концентраций матрицы. Для пула синтетических матриц для 647 микроРНК готовили серию разведений (15–1500 копий каждой матричной РНК в реакции ПЦР) на фоне тотальной РНК бактериофага MS2 и анализировали с помощью RT-qPCR. На графике представлена зависимость среднего значения Cq для всех анализов от концентрации матрицы.
Нормализация
1. Нормализация данных в qPCR с микроРНК
Цель нормализации – устранение в результатах анализов технических отклонений, не имеющих биологических причин. Нормализация имеет решающее значение для правильной интерпретации данных. Наиболее распространённые методы нормализации:
- Использование среднего значения уровня экспрессии всех часто экспрессируемых микроРНК в данном образце в качестве коэффициента нормализации 2. Это лучший метод нормализации при анализе ПЦР-панелей, содержащих большое количество анализов микроРНК.
- Идентификация и использование стабильно экспрессируемых референсных генов.
Центр анализа данных GeneGlobe® поддерживает оба подхода. Следует выяснить, какой из них обеспечивает наилучшую нормализацию в каждом конкретном случае. Нормализация с использованием шпилек РНК не рекомендуется, поскольку не позволяет учесть многие технические вариации – например, в содержании эндогенной РНК (Рис. 4).
Рис. 4. Нормализация данных qPCR для микроРНК из биожидкостей по среднему значению уровня экспрессии была наиболее успешной для минимизации стандартного отклонения по образцам. Выделение РНК выполняли с использованием 120 образцов плазмы в двух повторностях, добавляя в буфер для лизиса шпильки РНК. Профилирование микроРНК проводили для всех образцов РНК с использованием панели miRCURY LNA miRNA miRNome Human Panel I+II (742 микроРНК).
В качестве референсных генов используйте стабильно экспрессируемые эндогенные микроРНК, но не малые РНК более крупных видов, такие как 5S, U6 и snoRNA, которые иногда используются для нормализации в других типах образцов. Более крупные РНК могут иначе вести себя при выделении РНК. Они также имеют другой путь биогенеза и могут не секретироваться или не быть защищены в биологических жидкостях тем же способом, что и микроРНК.
Поскольку концентрация микроРНК, обнаруживаемых в образцах бесклеточных биожидкостей, обычно очень низкая, при использовании для нормализации средних значений уровня экспрессии необходимо экспрессировать большое количество микроРНК. Поэтому общей рекомендацией является выявление стабильно экспрессируемых референсных генов и использование их для нормализации, если количество обнаруженных микроРНК не выше 20–50.
2. Загрязнение клетками может влиять на нормализацию
При использовании для нормализации средних значений уровня экспрессии учитывайте, что клеточное загрязнение или гемолиз могут привести к высвобождению клеточной РНК в биожидкость. Это влияет на общее содержание микроРНК, а, значит, на среднее значение уровня экспрессии. Следовательно, крайне важно контролировать образцы РНК на наличие признаков клеточного загрязнения или гемолиза (раздел «Базовый контроль качества: стандарты для сыворотки и плазмы крови человека») и удостовериться, что гемолиз не влияет на микроРНК, выбранные как нормализаторы 3.
3. Выбор референсных генов
При использовании для нормализации стабильно экспрессируемых референсных генов советуем протестировать 5–6 генов-кандидатов, чтобы выявить 2–3 подходящих варианта. Кандидатов следует выбирать из набора генов, которые, как ожидается, будут стабильно экспрессироваться во всём диапазоне исследуемых образцов. Для выбора обычно проводят анализ литературы или ранее полученных данных (например, результаты панельного скрининга с помощью qPCR). Ряд микроРНК доступны на панелях ПЦР miRCURY LNA miRNA PCR Panels. Обычно это стабильно экспрессируемые гены со средним или высоким уровнем экспрессии, но их использование в качестве референсных необходимо оценивать отдельно в каждом исследовании. QIAGEN в своих исследованиях идентифицировал ряд микроРНК, обычно стабильно экспрессирующихся в сыворотке/плазме.
4. Проблемы, характерные для биожидкостей
Хранение и/или транспортировка нестабилизированной крови, а также определенные виды воздействия на организм могут привести к резким изменениям общего содержания микроРНК в образцах биожидкостей. В таких случаях идентификация стабильно экспрессируемых микроРНК может быть затруднена, а среднее значение уровня экспрессии всех микроРНК может быть нестабильным, из-за чего потребуется обратиться к альтернативным стратегиям нормализации – например, по соотношению микроРНК. Лучше всего избегать влияния трудноизмеримых внешних факторов, в частности, используя пробирки для стабилизации, такие как PAXgene Blood RNA Tubes или PAXgene Blood ccfDNA Tubes (подробнее в статье «Сбор и стабилизация образцов для анализа микроРНК»).
Дополнительные проблемы с нормализацией могут возникать при работе с образцами мочи – концентрация РНК сильно варьируется в зависимости о времени суток, гидратации организма и состояния здоровья. Поэтому следует соблюдать осторожность при выборе референсных генов; кроме того, может потребоваться нормализация объема мочи или уровня креатинина.
Для образцов других биожидкостей мы рекомендуем определять лучшие референсные микроРНК эмпирически. Дополнительные сведения об условиях экспериментов и анализе результатов qPCR с микроРНК представлены в руководстве miRCURY LNA miRNA PCR — Exosomes, Serum/Plasma and Other Biofluid Samples Handbook.
Контроль качества результатов анализа микроРНК методом qPCR
В таких сложных образцах, как биожидкости, для которых характерен низкий уровень микроРНК в сочетании с присутствием ингибиторов ПЦР, полученные значения Cq нередко высоки (в диапазоне 30-35). Эти значения приемлемы, если сигнал легко отличить от фона. Некоторые анализы более чувствительны к ингибированию, чем другие, поэтому целесообразно контролировать эффективность анализа непосредственно в процессе исследования.
В рамках процедуры контроля качества рекомендуется удостовериться, что:
- в кривой диссоциации присутствует единственный чистый пик, указывающий на уникальный продукт амплификации;
- температура плавления ампликона одинакова в пробах одного и того же анализа;
- эффективность амплификации свидетельствует об отсутствии ингибирования ПЦР;
- Cq образца чётко отличается от любого фона (например, по крайней мере, на 5 единиц ниже отрицательного контроля / пустой очистки).
Профили микроРНК следует проверять на предмет любых технических различий в обработке образцов. По нашему опыту, профиль микроРНК также может дать информацию о физиологическом состоянии донора образца. Например, высокие уровни miR-122 часто обнаруживаются в сыворотке или плазме крови людей, чья печень подверглась нагрузке при некоторых медицинских процедурах.
Литература
1. Mestdagh P. et al. Evaluation of quantitative miRNA expression platforms in the microRNA quality control (mirQC) study. Nature Methods, 2014.
2. Mestdagh P. et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology, 2009.
3. Pritchard C.C. et al. Blood cell origin of circulating microRNAs: a cautionary note for cancer biomarker studies. Cancer Prevention Research, 2012.




.jpg)