Медиатека
Сбор и стабилизация образцов для анализа микроРНК. Общие рекомендации по работе с биожидкостями
Оглавление:
•
Удаление остаточных клеток и клеточных фрагментов (Условия хранения)
•
Сыворотка и плазма крови
1. Как уменьшить влияние факторов, предшествующих анализу?
2. Предварительная обработка образцов
3. Пробирки для сбора крови
4. Время обработки от сбора крови до подготовки плазмы/сыворотки
5. Советы по предотвращению гемолиза
6. Значение центрифугирования и фильтрации
•
Моча
•
Экзосомы и другие ВВ
2. Предварительная обработка образцов
3. Пробирки для сбора крови
4. Время обработки от сбора крови до подготовки плазмы/сыворотки
5. Советы по предотвращению гемолиза
6. Значение центрифугирования и фильтрации
Определение профиля микроРНК в образцах биожидкостей – перспективный метод малоинвазивного выявления биомаркеров заболеваний. Однако он сопряжён с рядом проблем. Выявить микроРНК и измерить их количество в бесклеточных жидкостях сложнее, чем в тканях, клетках и цельной крови, из-за гораздо более низкой концентрации. Следует также принимать в расчёт ряд факторов, предшествующих анализу, таких как соблюдение условий сбора и хранения образцов и необходимость избегать гемолиза и загрязнения образцов тромбоцитами. МикроРНК в биожидкостях находятся в составе рибонуклеопротеиновых комплексов, либо внутри внеклеточных везикул (ВВ) – отделившихся от клеток мембранных пузырьков с различным содержимым. В обоих случаях микроРНК защищены от действия эндогенных РНКаз, но при выделении РНК эти структуры разрушаются, а, значит, РНКазы должны быть своевременно инактивированы.
Удаление остаточных клеток и клеточных фрагментов (Условия хранения)
Образцы сыворотки, плазмы, мочи и других биожидкостей после сбора следует центрифугировать в течение 5-15 минут при 3000 g либо предварительно отфильтровать. Например, с помощью фильтра с размером пор 0,8 мкм для удаления остаточных клеток и дебриса. Если дебрис нельзя убрать немедленно, образцы можно хранить при 2-8°C не более суток. Замораживание на этой стадии не допускается, поскольку вызовет лизис остаточных клеток и выход внутриклеточных микроРНК в бесклеточную жидкость. Бесклеточные образцы можно хранить при –20°C (краткосрочно) или –80°C (долгосрочно).
Сыворотка и плазма крови
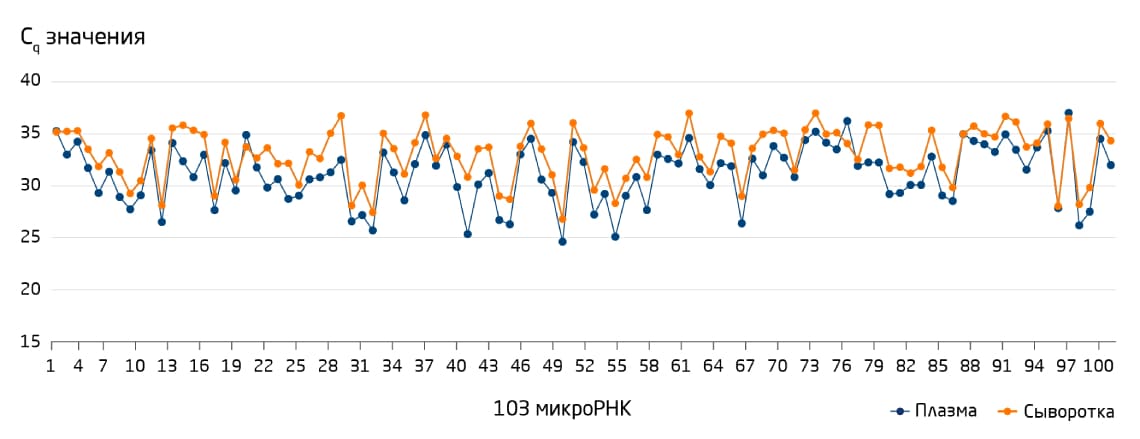
Биомаркеры успешно обнаруживаются в РНК, выделенной как из плазмы, так и из сыворотки крови, но при выборе материала для анализа следует учитывать некоторые нюансы. Как правило, сигналы, получаемые на плазме, несколько более сильные и дают больший разброс, чем сигналы, получаемые на сыворотке (Рис. 1). Однако процесс подготовки образцов плазмы в меньшей степени подвержен изменениям, чем процесс подготовки сыворотки, в котором могут варьировать время коагуляции и температура. Нежелательный фон в сыворотке также может увеличиваться за счёт её загрязнения тромбоцитами с последующим высвобождением из них везикул при коагуляции.
Рис. 1. Профили микроРНК из сыворотки и плазмы крови очень похожи. Представлено сравнение значений Cq, полученных для 103 микроРНК, наиболее распространённых в сыворотке и плазме, профилированных с помощью системы miRCURY® LNA® miRNA PCR System.
1. Как уменьшить влияние факторов, предшествующих анализу?
Первый шаг в подготовке и плазмы, и сыворотки – сбор цельной крови. Чтобы избежать гемолиза при флеботомии, взятие крови должно осуществляться опытным персоналом. Решающее значение для точности анализа микроРНК в плазме и сыворотке имеет сохранность РНК во время и после взятия крови. Используйте одинаковые высококачественные пробирки для всех образцов в исследовании и стандартизируйте обработку. Особенно время между взятием крови и подготовкой сыворотки или плазмы.
PreAnalytiX предлагает пробирки для сбора крови, минимизирующие технические отклонения. Пробирки PAXgene® Blood RNA Tubes для выделения клеточной микроРНК из цельной крови защищают молекулы РНК от деградации и обеспечивают лизис всех клеток в образце, чтобы минимизировать изменения ex vivo из-за усиления и подавления экспрессии генов. Циркулирующие бесклеточные микроРНК можно выделять из плазмы, которая получена из крови, собранной в пробирки PAXgene Blood ccfDNA Tubes, стабилизирующие эритроциты и предотвращающие апоптоз лейкоцитов
1.
Для получения оптимальных результатов из архивных образцов следует выбирать только те образцы, которые были собраны и обработаны по одному протоколу. При проведении многоцентровых исследований нужно учитывать, что разные лаборатории могут использовать разное оборудование и процедуры для сбора образцов.
2. Предварительная обработка образцов
Для получения методических рекомендаций по сбору и подготовке сыворотки и плазмы крови пользуйтесь стандартными процедурами EDRN (Early Detection Research Network), опубликованными Национальным институтом рака США 2 и техническим спецификациям CEN/TS 16835-1 & 3:2015 3 от Европейского комитета по стандартизации.
3. Пробирки для сбора крови
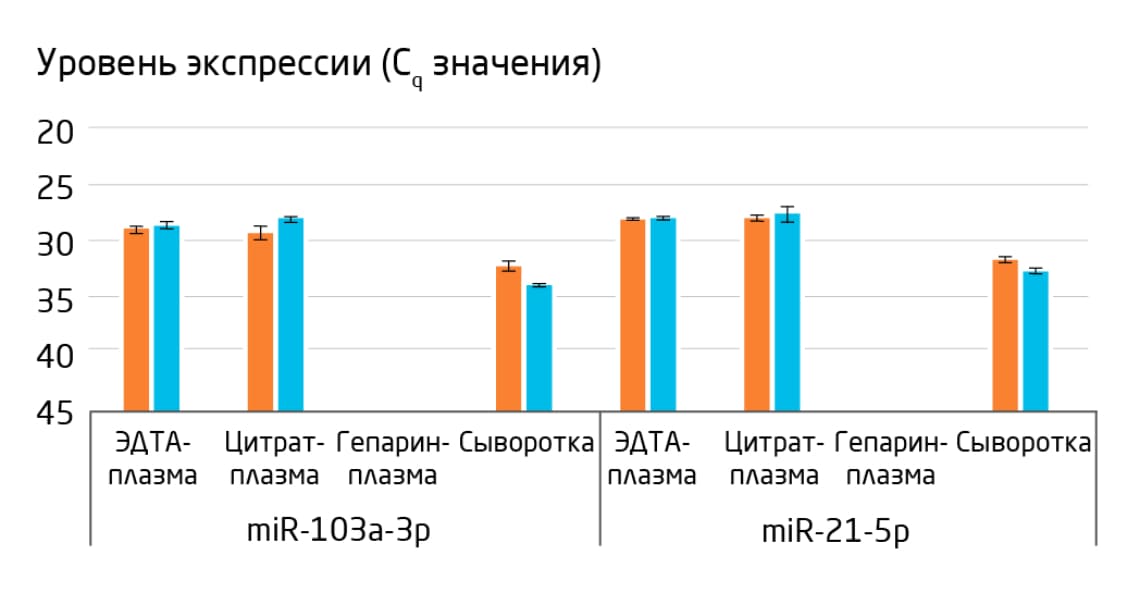
Во многих лабораториях успешно применяются пробирки PAXgene Blood ccfDNA Tubes, но можно брать и другие. Используйте только те пробирки, которые содержат реагенты для стабилизации клеток, не изменяющие биомолекулы химически. Если такого рода стабилизация недоступна, в качестве антикоагулянтов рекомендуется брать ЭДТА и цитрат. Гепарин следует избегать, поскольку он ингибирует последующие этапы анализа, такие как синтез кДНК и ПЦР (Рис. 2 и Рис. 3). Для случаев, когда без гепарина обойтись нельзя, компания QIAGEN разработала протокол его удаления из образцов крови, сыворотки или плазмы и из препаратов изолированной РНК.
Рис. 2. Гепариновые пробирки не подходят для анализа микроРНК. Показана пригодность различных препаратов крови для ПЦР микроРНК. ПЦР в реальном времени для miR-103a-3p и miR-21-5p проводилась с использованием трехкратных реакций обратной транскрипции на тотальной РНК, выделенной из ЭДТА-плазмы, цитрат-плазмы, гепарин-плазмы или сыворотки. Показаны средние значения Cq для каждой тройки, продемонстрирована надежная амплификация из всех источников, кроме гепарин-плазмы.
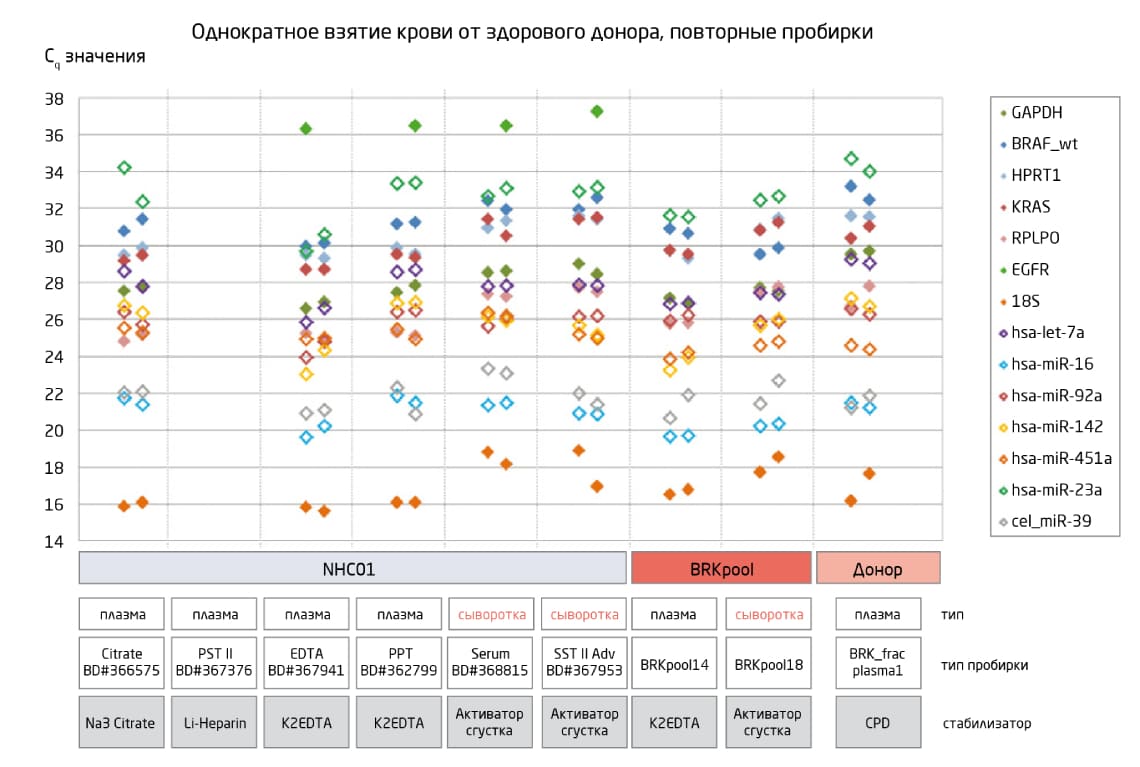
На репрезентативность отдельных транскриптов РНК могут повлиять даже рекомендованные пробирки и антикоагулянты (Рис. 3), что является ещё одной причиной для использования одинаковых пробирок и протоколов на протяжении всего исследования.
Рис. 3. Для процедур выделения РНК подходит широкий спектр пробирок, однако репрезентативность отдельных транскриптов может различаться. Использование пробирок с гепарином не рекомендуется. РНК выделяли с помощью набора exoRNeasy Maxi Kit.
4. Время обработки от сбора крови до подготовки плазмы/сыворотки
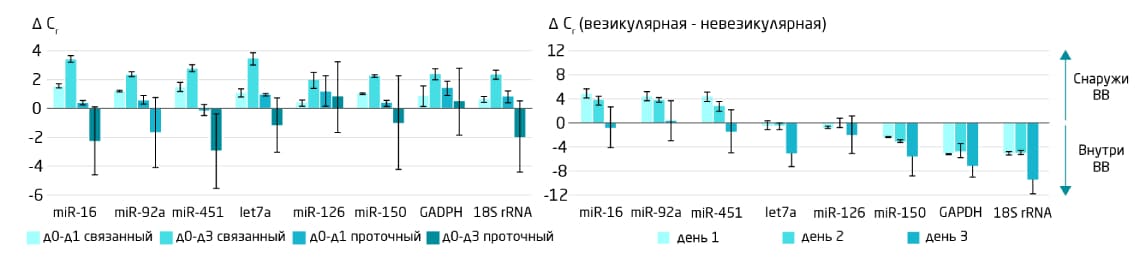
При отсутствии стабилизирующих пробирок образцы крови необходимо обрабатывать сразу после сбора. Если их невозможно центрифугировать немедленно (или при приготовлении сыворотки, по истечении времени свёртывания), их следует хранить при комнатной температуре не более 4 часов. Хранение при 4°C, указанное в стандартных протоколах EDRN или CEN/TS, может привести к лизису тромбоцитов, результатом чего станет загрязнение профиля бесклеточной микроРНК. Также может произойти высвобождение дополнительной везикулярной РНК из клеток крови. Количество же бесклеточной невезикулярной РНК, наоборот, уменьшится. Результатом может стать значительное изменение соотношения везикулярной и невезикулярной РНК (Рис. 4).
Рис. 4. Влияние времени хранения крови до подготовки плазмы на количество избранных микроРНК. Кровь либо перерабатывали в плазму в течение 2 или менее часов после взятия, либо хранили при комнатной температуре в течение 1 или 3 дней. РНК из ВВ выделяли с помощью набора exoRNeasy Midi Kit, невезикулярную РНК выделяли из стока связывающих ВВ колонок exoEasy с использованием набора miRNeasy® Serum/Plasma Kit, после чего проводили анализ образцов с помощью количественной ПЦР. Уровень РНК вне ВВ увеличивается в течение первых суток после забора крови, а затем снижается. Уровень РНК внутри ВВ со временем возрастает. Предположительно, из-за продолжающегося высвобождения ВВ клетками крови, что увеличивает нежелательный фон.
5. Советы по предотвращению гемолиза
- использовать одинаковые рекомендованные приспособления для сбора образцов на протяжении всего исследования, следовать инструкциям производителей;
- не брать кровь из гематомы;
- избегать ошибок и травм при флеботомии;
- не вспенивать образец;
- заполнять вакуумные пробирки полностью.
Выявить гемолиз в образцах сыворотки и плазмы можно спектрофотометрически. Оксигемоглобин даёт пик поглощения при 414 нм, который можно использовать для идентификации образцов, затронутых гемолизом 4. На профиль микроРНК также могут влиять остаточные тромбоциты и микрочастицы, которые можно эффективно удалить центрифугированием даже из архивных образцов 5.
6. Значение центрифугирования и фильтрации
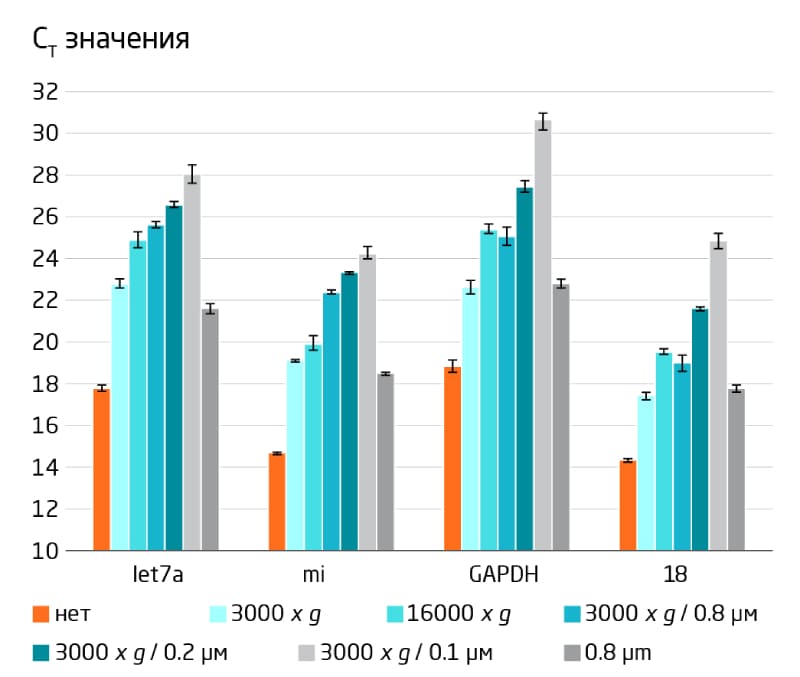
Центрифугирование или фильтрация необходимы для удаления фрагментов клеток из плазмы перед выделением ВВ или везикулярной РНК. Однако эти этапы предварительной обработки также могут влиять на репрезентативность РНК из разных классов везикул. Влияние на концентрацию и распределение по размерам везикул не пропорционально влиянию на репрезентативность РНК, что указывает на неравномерное распределение РНК в везикулах (Рис. 5, Таблица 1). Мы рекомендуем центрифугирование при 3000 g, либо фильтрацию через фильтр с размером пор 0,8 мкм.
Рис 5. Влияние центрифугирования и фильтрации для удаления остаточных клеток и клеточных фрагментов из плазмы на содержание РНК. Образцы плазмы подвергали дополнительному центрифугированию при 3000 или 16000 g и/или фильтрации с использованием мембраны с размером пор 0,8, 0,2 или 0,1 мкм, с последующим выделением РНК с использованием набора exoRNeasy Maxi Kit. При отсутствии дополнительной обработки основная масса выделенной РНК происходит из остаточных клеток и клеточных фрагментов (> 0,8 мкм). Центрифугирование при 3000 x g и 0,8 мкм удаляет РНК с очень похожей эффективностью. Повышение скорости центрифугирования или использование фильтров с меньшими размерами пор приводят к удалению более крупных ВВ, и в результате выделяется меньше РНК.
| Размер частиц среднее (nm) | Размер частиц DCO (nm) | Концентрация частиц (в мл плазы) | |
| 3 000 x g | 143,3 | 133,7 | 5,34e10 |
| 16 000 x g | 162,2 | 161,3 | 4,32e10 |
| 3 000 x g, 0,8 µm | 159,2 | 155,6 | 4,80e10 |
| 3 000 x g, 0,2 µm | 165,1 | 161,9 | 5,10e10 |
| 3 000 x g, 0,1 µm | 123,1 | 110,9 | 2,34e10 |
| 0,8 µm | 153,8 | 143,2 | 4,54e10 |
Таблица 1. Влияние центрифугирования и фильтрации для удаления остаточных клеток и клеточных фрагментов из плазмы на концентрацию частиц и распределение по размерам, измеренное с помощью анализа траекторий наночастиц.
Моча
1. Цельная моча, бесклеточная моча или экзосомы?
В образцах мочи микроРНК присутствуют в составе экзосом, белковых комплексов и клеток, попавших в мочу. В исследованиях на людях цельная моча может быть разделена на клеточный осадок и бесклеточный супернатант. Экзосомы выделяются из бесклеточного супернатанта. Профилирование микроРНК выполнимо для любой из этих фракций в зависимости от цели исследования. Но уровень РНК из остаточных клеток на несколько порядков выше, чем уровень бесклеточной РНК, поэтому для анализа внеклеточной РНК необходимо удалить остаточные клетки — точно так же, как делают с плазмой или сывороткой.
Утренняя моча обычно более концентрированная, чем моча, собранная позже, и может содержать различные метаболиты, мешающие анализу РНК. Чтобы уменьшить эффект потенциальных ингибиторов, объем мочи для выделения коротких РНК не должен превышать 2 мл (утренняя моча) либо элюаты должны быть соответственно разбавлены перед анализом.
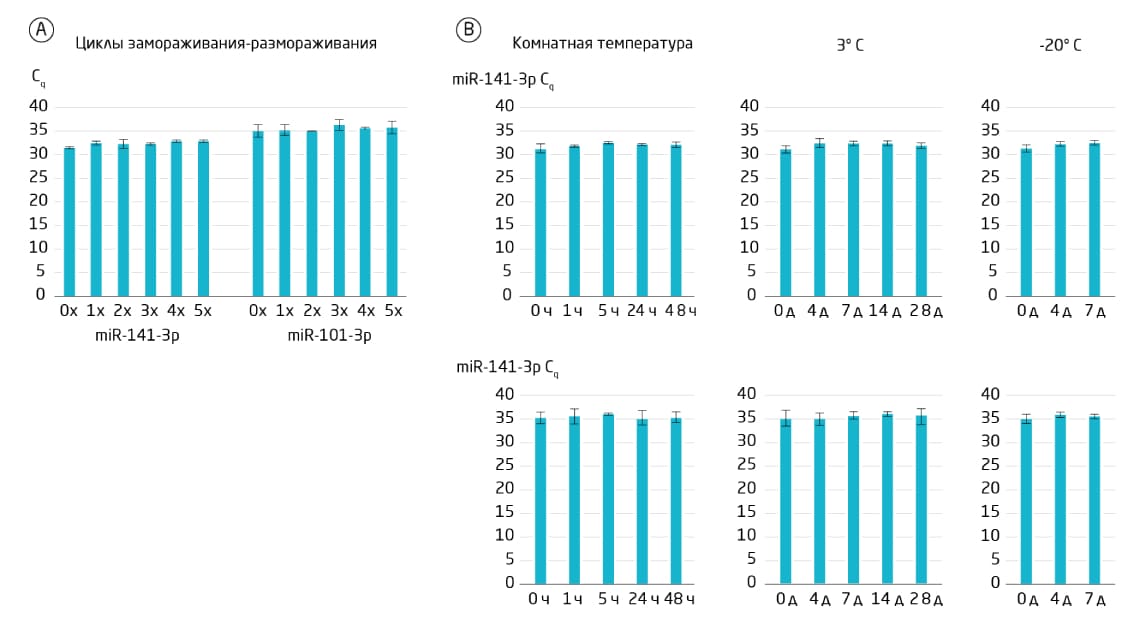
Рис. 6. Стабильность микроРНК в бесклеточной моче человека. A. Перед выделением РНК бесклеточные образцы мочи подвергались 1-5 циклам замораживания-оттаивания, что оказывало минимальное влияние на амплификацию микроРНК. B. Образцы бесклеточной мочи хранили до выделения РНК в течение указанного времени при комнатной температуре, 3°C или –20°C. Длительное хранение (до 48 часов при комнатной температуре или до 28 дней при 3°С или -20°С) оказывало минимальное влияние на амплификацию микроРНК. Несмотря на то, что последствия обработки и хранения образцов привели к потере не более 2 единиц Cq, мы рекомендуем стандартизировать протоколы обработки и хранения образцов, немедленно обрабатывать образцы мочи путем центрифугирования для удаления клеточного дебриса и хранить при температуре –80°C.
2. Сбор и подготовка образцов мочи
Хотя микроРНК очень стабильны в бесклеточных образцах мочи (Рис. 6), мы советуем использовать стандартизированные протоколы обработки и хранения образцов. Количество различных типов клеток в моче может изменяться, например, в ответ на проведение определённых медицинских процедур (Рис. 7). В бесклеточном супернатанте находятся микроРНК, содержащиеся в экзосомах и белковых комплексах. У здоровых людей уровень микроРНК, обнаруживаемых в этой фракции образца, обычно очень низок. Она полезна для анализа токсикологических биомаркеров, поскольку может содержать микроРНК, высвобождение которых происходит при токсическом воздействии на клетки. Анализ микроРНК в бесклеточном супернатанте мочи требует осторожности на всех этапах, чтобы свести к минимуму лизис клеток.
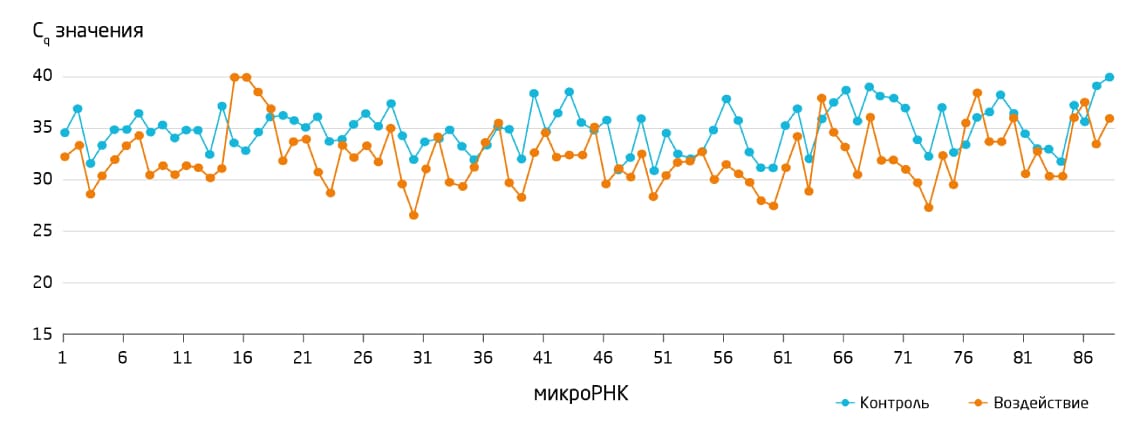
Рис. 7. Изменения профиля микроРНК, выявленные в цельной моче крыс в результате обработки нефротоксином. Некоторые микроРНК демонстрируют повышенные уровни экспрессии (снижение Cq) в цельной моче крыс после обработки нефротоксином. Профилирование микроРНК проводили с использованием системы miRCURY LNA miRNA PCR.
Экзосомы и другие ВВ
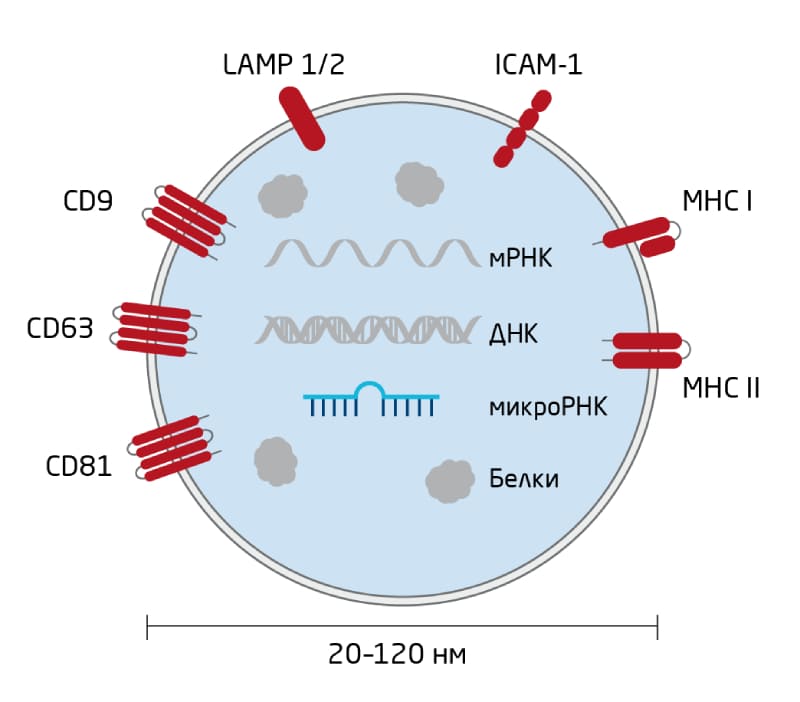
Экзосомы – это клеточные мембранные частицы размером от 20 до 120 нм (Рис. 8). Их важность для нормального функционирования клеток и развития заболеваний сделала их интересными мишенями для использования неинвазивных циркулирующих биомаркеров. ВВ выделяются из клеток в окружающую среду и обнаруживаются во всех жидкостях организма. Считается, что они работают как гормоноподобные мессенджеры, переносящие биомолекулы между клетками для осуществления различных важных клеточных функций, в том числе:
- иммунной регуляции;
- коагуляции крови;
- миграции клеток;
- дифференцировки клеток;
- межклеточной связи.
Рис. 8. Структура экзосомы. Экзосомы представляют собой инкапсулированные в мембрану ВВ, обычно размером от 20 до 120 нм, содержащие множество макромолекул, включая белки, мРНК и микроРНК. Недавно сообщалось, что они также содержат ДНК. Ряд поверхностных белков обнаружены исключительно в экзосомах, но не в других микровезикулах.
МикроРНК активно и избирательно включаются в ВВ, поэтому популяция везикулярных микроРНК представляет собой подмножество микроРНК, обнаруживаемых в сыворотке и плазме (Таблица 2) или других биожидкостях. ВВ обычно содержат большее количество малых видов РНК по сравнению с клетками и почти не содержат интактных рибосомных РНК.
| Фракция | микроРНК в сыворотке | микроРНК в плазме |
| ВВ гранула | 127 | 104 |
| Супернатант | 46 | 74 |
| Вся биологическая жидкость | 151 | 142 |
Таблица 2. Большинство микроРНК обнаруживается во всей биологической жидкости, а не в ВВ или свободных от ВВ супернатантах, полученных из сыворотки/плазмы. Все микроРНК, обнаруженные в осадке ВВ или супернатанте, также могут быть обнаружены во всех образцах биожидкости. ВВ и супернатант выделяли из 200 мкл сыворотки или плазмы с использованием набора miRCURY Exosome Serum/Plasma Kit (арт. 76603). РНК выделяли либо непосредственно из 200 мкл сыворотки или плазмы, либо из осадка ВВ и супернатанта. Среднее количество микроРНК, выявленных на панели miRCURY LNA miRNA PCR Serum/Plasma Focus Panel, содержащей 179 микроРНК.
1. Зачем выделять ВВ?
Выделение ВВ позволяет анализировать микроРНК, которые избирательно и активно в них включаются и секретируются клетками в различные биожидкости. Кроме того, выделение ВВ увеличивает концентрацию микроРНК в образце, усиливая сигналы микроРНК в разбавленных образцах, таких как моча и спинномозговая жидкость. Результатом становится обнаружение большего количества микроРНК.
2. Методы выделения ВВ
ВВ выделяются различными способами, включая аффинные методы, преципитацию, эксклюзионную хроматографию, дифференциальное центрифугирование и ультрацентрифугирование. В зависимости от метода подготовки и обработки биожидкости перед выделением РНК состав выделенных везикул и совместная очистка не везикулярной бесклеточной микроРНК могут варьироваться, что приводит к изменчивости профилей микроРНК. Поэтому протоколы сбора и предварительной обработки образцов нуждаются в стандартизации и контроле. Процедуры выделения ВВ доступны для большинства биожидкостей, включая сыворотку, плазму, спинномозговую жидкость и мочу. Из-за более высокого содержания РНК в клетках даже небольшое количество клеточного дебриса может оказать значительное влияние на профилирование РНК в бесклеточных жидкостях, поэтому клеточные материалы должны быть удалены как можно скорее после взятия крови, чтобы снизить риск появления дополнительного фона от везикул, полученных из клеток крови и образовавшихся in vitro. Для выделения везикулярной РНК из сыворотки и плазмы выполняйте начальную стадию центрифугирования с низкой скоростью, чтобы отделить клетки, с последующим этапом центрифугирования с высокой скоростью для удаления оставшегося клеточного мусора.
Литература
1. Gahlawat A.W. et al. Evaluation of storage tubes for combined analysis of circulating nucleic acids in liquid biopsies. International Journal of Molecular Sciences, 2019.
2. Early Detection Research Network (EDRN) Standard Operating Procedures. National Cancer Institute (NCI).
3. CEN/TS 16835-3:2015: Molecular in vitro diagnostic examinations – Specifications for pre-examination processes for venous whole blood – Part 3: Isolated circulating cell free DNA from plasma. European committee for standardization, 2015.
4. Blondal T. et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids. Methods, 2013.
5. Cheng H.H. et al. Plasma processing conditions substantially influence circulating microRNA biomarker levels. PLoS ONE, 2013.




.jpg)