Медиатека
Орган на чипе: преодолевая разрыв между in vivo и in vitro
Оглавление:
•
Что такое орган-на-чипе?
•
Как устроен орган-на-чипе?
•
Где применяется орган-на-чипе?
Технология орган-на чипе – это платформа нового поколения для изучения патофизиологии человека. Сочетая достижения тканевой инженерии и микротехнологий, она постепенно завоевывает интерес у исследователей по всему миру. Функции интересующих органов или даже групп органов теперь можно наблюдать in vitro в условиях, наиболее приближенных к живому организму. Чтобы разобраться в этом вопросе, мы собрали для вас всю актуальную информацию про орган-на-чипе, опираясь на статью, опубликованную в журнале Nature reviews в мае 2022 1.

Рис. 1. Орган на чипе. Источник: Emulate
Что такое орган-на-чипе?
Орган-на-чипе (organ-on-a-chip, или OoС) — это система, содержащая искусственные или естественные миниатюрные ткани, выращенные внутри микрожидкостных, или микрофлюидных, чипов. Их можно рассматривать как промежуточную технологию между исследованиями in vivo и 2D- и 3D-культурами клеток, которая предоставляет возможность работы со сложными клеточными культурами без ограничений живого организма, но при этом обеспечивает улучшенную, более сложную модель по сравнению с клеточными культурами.
Чип представляет собой микрожидкостное устройство, содержащее сети тончайших микроканалов для точного управления мельчайшими объемами растворов — от пиколитров до миллилитров. Чипы предназначены для обеспечения среды, подобной in vivo, сборки клеток в трехмерную ткань, способную воспроизводить необходимые функции органа, и для культивирования органотипической культуры клеток. Иначе говоря, на чипах выращиваются и содержатся «органы», которые имитируют одну или несколько тканеспецифичных функций. Чипы в свою очередь воспроизводят клеточные и внеклеточные характеристики органа и его микроокружения, чтобы он мог реагировать на биохимические и физические сигналы, имитируя физиологию человека.
Как устроен орган-на-чипе?
В целом каждый OoC — это ткань на микрофлюидном чипе с дополнительным оборудованием, включающим насосы, датчики и микроскопы. Однако при разработке конкретного OoC важнее всего функциональные возможности желаемой системы. Первый выбор стоит между одноорганной (single-organ) или мультиорганной (multi-organ) системами. Мультиорганные системы используют для изучения взаимодействия между тканями и органами; их обычно называют «тело на чипе» (body-on-a-chip).
Далее нужно сформировать ткани внутри OoC, а также выбрать его архитектуру. Орган можно сформировать из целой ткани (подход «сверху-вниз») или из отдельных клеток (подход «снизу-вверх»). В архитектуре устройств ОоС обычно выделяют два класса: solid organ chip, в котором клетки культивируются в виде трехмерных тканевых масс, и barrier tissue chip, которые образует естественный барьер из клеток между жидкостными отсеками. Выбор материала самого чипа также зависит от множества факторов. Идеального стандартного материала не существует, так как все они имеют свои преимущества и недостатки. Поэтому типичное устройство OoC состоит из различных комбинаций материалов, среди которых силиконовый каучук, стекло и термопласты. Не менее важен выбор источника клеток (первичные, иммортализованные и полученные из стволовых клеток), для чего также существует ряд критериев: специфичность для определенного пациента, функции клеток, способность к пролиферации и другие.
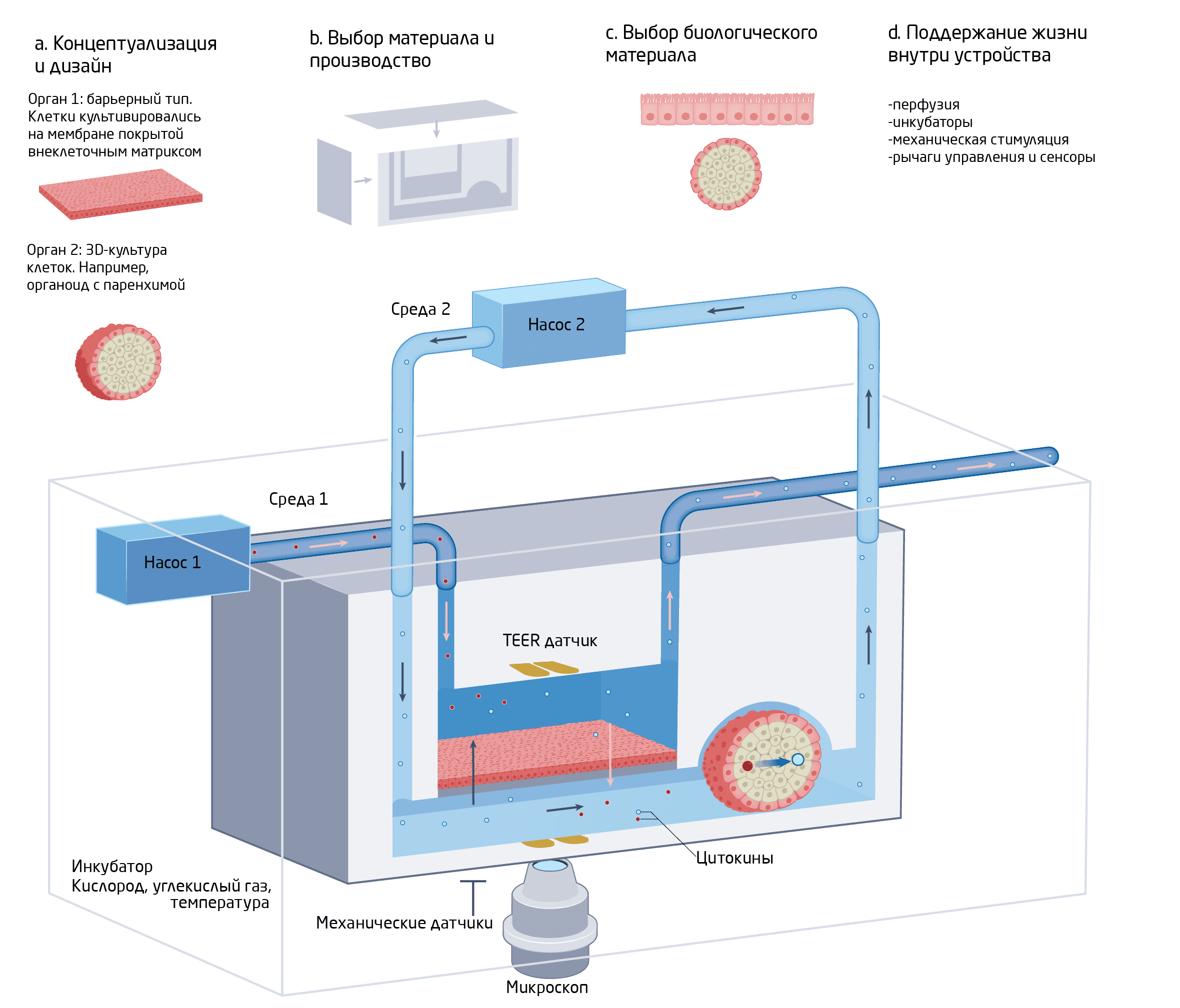
Рис. 2. Дизайн органа-на-чипе 1.
Итак, полдела сделано — орган на чипе готов. Теперь он должен быть жизнеспособным в течение всего исследования. Как этого добиться?
Крайне важно выбрать правильную среду для культивирования клеток — в ней должно содержаться все, что нужно для развития ткани. Перфузия среды, имитирующая систему кровообращения, является отличительной чертой устройств OoC — для этого в системе находятся специальные насосы.
Также микроокружение клеток — растворимые факторы, внеклеточный матрикс (ВКМ) и соседние клетки — необходимо тщательно контролировать, чтобы они функционировали должным для данной ткани образом.
И, разумеется, важно проводить постоянный мониторинг состояния системы. Наиболее распространенным видом контроля является микроскопическое исследование, чтобы регулярно проверять клетки или срезы ткани. Жидкостная хроматография, масс-спектрометрия и мультиплексный анализ — это тоже полезные методы, поскольку позволяют одновременно измерять широкий спектр различных химических веществ, многие из которых являются чувствительными биомаркерами.
Где применяется орган-на-чипе?
Как система in vitro, OoC не могут всесторонне охватить всю физиологию органа или тела, поэтому большинство OoC разрабатываются с учетом их применения в конкретном исследовании.
1. Тестирование фармацевтических и химических соединений
Коммерческое использование систем OoC сосредоточено в первую очередь на разработке лекарств. Возможность оценить их эффективность и токсичность в ходе доклинических испытаний — это огромное преимущество, позволяющее компании выбирать наилучших кандидатов.
2. Тестирование биоматериала
Многие методы лечения основаны на использовании биоматериалов, в том числе хирургические устройства, имплантаты и заменители искусственных тканей. Платформы OoC можно использовать для изучения биосовместимости и эффективности биоматериалов в интересующей среде.
3. Биологические исследования
OoC-системы обеспечивают специфичную для человека экспериментальную платформу для изучения заболеваний. Моделирование заболеваний приобретает все большее значение для клинической разработки терапевтических средств и важно в случае редких заболеваний, где клинические испытания могут быть ограничены небольшими когортами пациентов. Например, была разработана платформа для исследования возможности моделирования кишечных коронавирусных инфекций и тестирования противовирусных препаратов 2. Моделирование вирусной инфекции гораздо сложнее и требует присутствия множества различных органов, включая иммунные компоненты. Также ОоС используют для имитации клеточного микроокружения, исследования функций одного органа или взаимодействия нескольких органов. Например, ученые разработали мульти-OoC платформу для имитации метаболизма лекарств в мультиорганной (группы из 4, 7 или даже 10 органов) системе 3.
Косметическая, пищевая и химическая промышленность могут извлечь огромную выгоду из OoC технологий как для производства, так и для тестирования, поскольку все еще продолжается поиск хороших альтернатив испытаниям на животных.
Хотя с помощью устройств OoC уже можно моделировать многие системы органов, важно понимать некоторые из текущих ограничений и проблем в этой области. Производственные и рабочие процессы еще не стандартизированы, поэтому пользователям необходимо затрачивать время и ресурсы для настройки системы, а это неизбежно ограничивает производительность.
Орган-на-чипе пока не может воспроизвести всю многогранность физиологии человека. Например, системы сосудов и протоков в тканях слишком сложные, чтобы их можно было полностью воссоздать на искусственных платформах. К тому же, пока сложно отслеживать динамику системы в реальном времени — по-прежнему доступны только конечные показания.
Во время исследования могут возникать экспериментальные артефакты, влияющие на результат. Например, менее чувствительная реакция на дозу лекарственного средства может быть связана с его адсорбцией на поверхности чипа. Поэтому результаты, полученные с помощью ОоС, необходимо проверять на уже существующих моделях in vitro и in vivo.
Орган-на-чипе постепенно преодолевает разрыв между обычными клеточными культурами и моделями животных или людей. Технологии OoC значительно продвинулись, и интерес к ним будет продолжать расти в ближайшие годы. Хотя есть некоторые проблемы, которые все еще необходимо решить, технология OoC находится на пути к тому, чтобы получить широкое признание и, возможно, в будущем стать стандартом в наборе инструментов современной лаборатории.
Литература
1. Leung C.M. et al. A Guide to the Organ-on-a-chip. Nature Review Methods Primers, 2022.
2. Bein A. et al. Enteric Coronavirus Infection and Treatment Modeled With an Immunocompetent Human Intestine-On-A-Chip. Frontiers in Pharmacology, 2021.
3. Edington C.D. et al. Interconnected microphysiological systems for quantitative biology and pharmacology studies. Scientific Reports, 2018.




.jpg)