Медиатека
Автостопом по методам генной инженерии
Оглавление:
• Молекула жизни в руках ученых, или что можно делать с ДНК • Методы геномного редактирования
Лабораторию ученых, занимающихся генной инженерией, с чем только не сравнивают – с кухней, на которой, согласно точным рецептам (протоколам), что-то смешивают, варят и замораживают; с кружком кройки и шитья, где ученые режут, перекраивают, сшивают ДНК и другие сложные молекулы; и даже с мастерской бога, где на свет рождаются новые существа, ранее не существовавшие в природе. Все эти сравнения действительно недалеки от истины. Чтобы разобраться в том, что из себя представляет генная инженерия, мы кратко рассмотрим базовые методы и основные принципы создания организмов с измененным геномом.

Молекула жизни в руках ученых, или что можно делать с ДНК
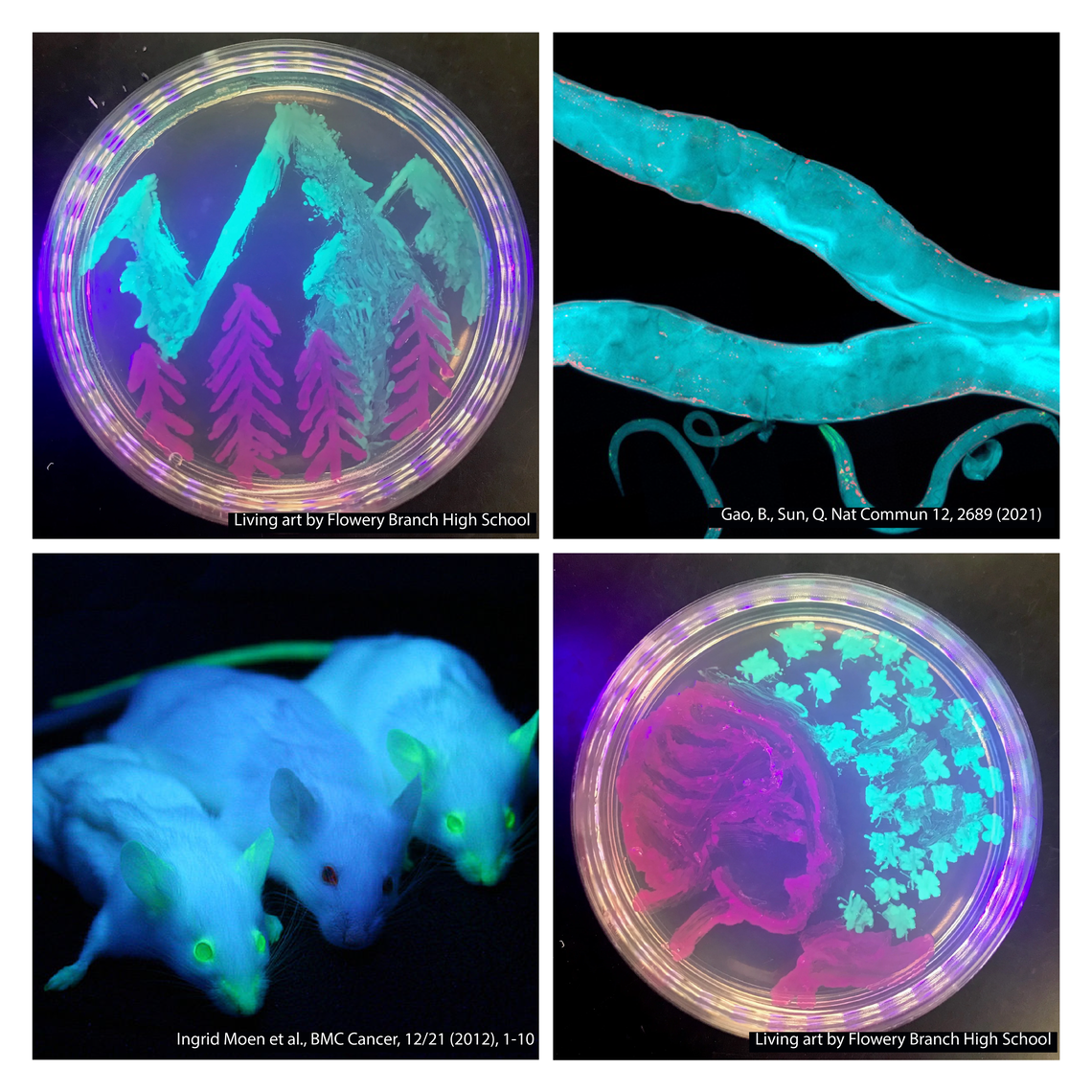
ДНК – важнейшая молекула, в которой заключен весь генетический материал организма. В руках ученых эта молекула превратилась в податливый материал, с помощью которого можно творить самые настоящие чудеса – от произведений искусства до научных прорывов.
Самый базовый метод работы с ДНК – её экстракция (выделение) из клеток. Основные этапы включают разрушение клеток и очистку ДНК от других молекул. Сейчас это делается быстро и просто с помощью готовых наборов для экстракции ДНК. Дальнейшие манипуляции с выделенной ДНК относят к in vitro методам, о которых пойдет речь ниже.
1. Секвенирование
Раствора ДНК в пробирке недостаточно для целенаправленных манипуляций с ней, важно также знать нуклеотидную последовательность ДНК, которую можно определить с помощью секвенирования (Рис. 1). Разнообразные методы секвенирования решают обширный круг задач – от «прочтения» коротких фрагментов ДНК до получения и реконструкции полных геномов организмов. Секвенирование определенных областей генома позволяет выявлять мутации в ДНК и диагностировать генетические заболевания. Лавинообразно растущее количество прочитанных геномов разных организмов дало мощный толчок к развитию геномики и эволюционной биологии. 1, 2
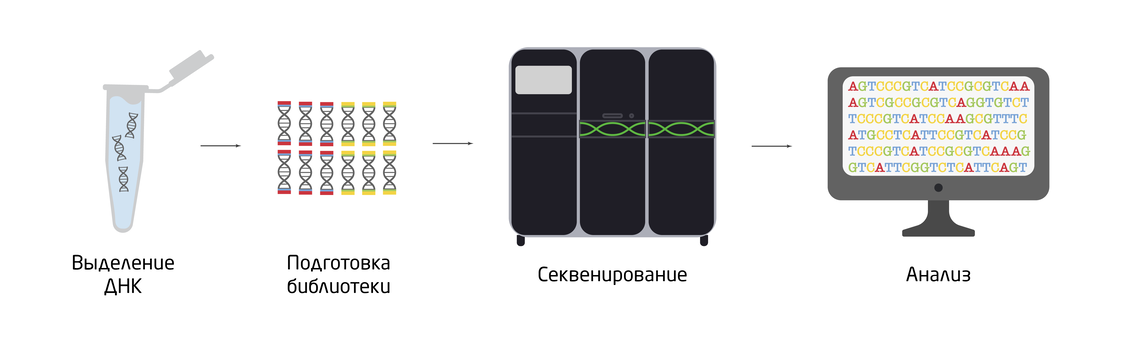
Рис. 1. Схематический процесс секвенирования ДНК.
2. Амплификация
Если исследователю необходимо работать не со всей выделенной ДНК, а с её определенной областью, например, конкретным геном или регуляторным элементом, на помощь приходит метод, который позволяет получить множественные копии целевого фрагмента ДНК – полимеразная цепная реакция (ПЦР) (Рис. 2). Этот метод прост и идейно, и в реализации, но он настолько глубоко вошел в практику (от научных исследований и использования в медицинских целях до криминалистики, установления отцовства и эко-мониторинга), что сейчас без него сложно представить работу в лаборатории. Метод основан на достраивании ферментом ДНК-полимеразой второй цепи ДНК в пределах заданного участка, фланкированного короткими комплиментарными олигонуклеотидами - праймерами. В специальном приборе, амплификаторе, буквально за пару часов можно получить миллиарды копий нужного фрагмента ДНК. 3

Рис. 2. Полимеразная цепная реакция (ПЦР).
3. Молекулярное клонирование
Разные манипуляции с ДНК возможны благодаря использованию ферментов, например, вышеупомянутая ДНК-полимераза. Еще один важный класс ферментов – нуклеазы и их подкласс эндонуклеазы рестрикции, или рестриктазы. Они узнают в молекуле ДНК определенные последовательности и разрезают её, выступая в роли молекулярных «ножниц». «Сшивать» молекулы ДНК друг с другом можно с помощью фермента ДНК-лигазы. Таким образом, молекулы ДНК можно разрезать, комбинировать между собой и снова сшивать, а по ходу этих действий можно также вносить в них изменения (мутации). Такие молекулы ДНК называют рекомбинантными. Они – главный инструмент в работе генного инженера. Рекомбинантную ДНК можно «запрограммировать» выполнять определенные функции в клетке.
Следующим шагом является внедрение ДНК в живые клетки. В зависимости от их типа этот процесс называют трансформацией (в бактерии, растения, грибы), трансфекцией (в клетки животных) или трансдукцией (внедрение ДНК в составе вирусов в любые клетки) (Рис. 3). Принципов доставки ДНК в клетки достаточно много и выбираются они также в зависимости от цели и типа клеток: химическая трансфекция с помощью липокатионных реагентов, электропорация, фотопорация, микроинъекции и «генные пушки», импалефекция, агроинфильтрация и другие. Весь процесс создания рекомбинантной молекулы ДНК с заданными функциями, её последующим внедрением и размножением в живых клетках называют молекулярным клонированием. Это фундамент генной инженерии и базовый принцип создания генетически-модифицированных клеток и организмов (ГМО) – от простейших бактерий до человека. 4
Кроме того, можно создавать абсолютно новые молекулы ДНК с нуля, синтезируя их химическими методами. Так, например, в 2010 году в лаборатории Крейга Вентера была создана первая в мире жизнеспособная бактериальная клетка, названная Синтия, с полностью искусственным геномом. 5
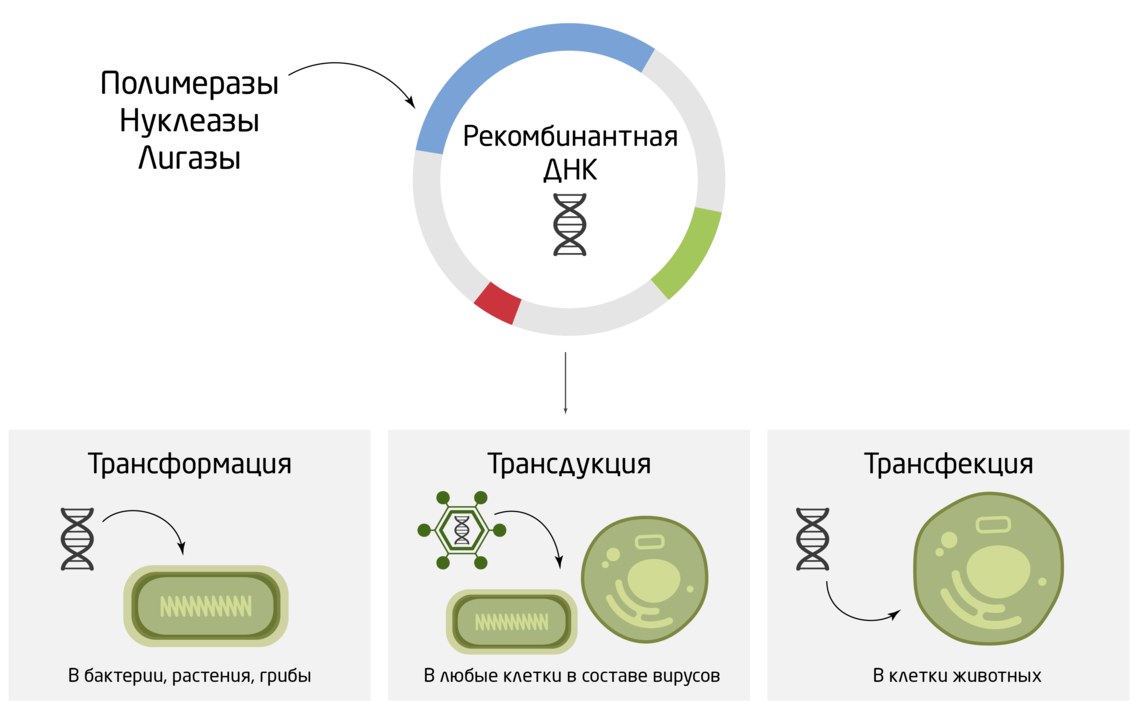
Рис. 3. Методы внедрения ДНК в живые клетки.
Методы геномного редактирования
Выше были описаны in vitro методы работы с ДНК, однако гораздо сложнее, но при этом важнее и интереснее работать с ДНК внутри живых клеток в составе генома, не выделяя её, т.е. in vivo. Направленное внесение изменений в геном называется геномным редактированием. Сегодня это крайне перспективное направление генной инженерии.
1. Зачем нужно редактировать геном?
Ответом на этот вопрос служат сразу несколько фундаментальных целей. Во-первых, исследовательская. Имея секвенированные последовательности геномов живых организмов, мы все еще далеко не полностью понимаем, как эти геномы устроены и функционируют, а возможности вносить изменения в ДНК очень помогают продвинуться в изучении этих вопросов. Например, функциональный анализ генов или регуляторных элементов. С помощью методов геномного редактирования можно удалять или «выключать» определенные гены с последующим наблюдением фенотипических эффектов. Такой способ называют нокаутом гена. Таким же образом можно вводить в геномную ДНК новые гены (нокин) или копировать уже имеющиеся, увеличивая их продуктивность (овэрэкспрессия). Кроме того, можно исправлять «сломанные» гены. Это вторая фундаментальная цель геномного редактирования, которая заключается в возможности исправлять генетические дефекты, моделировать и лечить наследственные заболевания. Прикладные цели геномного редактирования также обширны – создание новых сортов растений, выведение пород животных, получение новых штаммов микроорганизмов с улучшенными свойствами, новыми характеристиками и функциями для нужд сельского хозяйства и биотехнологий.
2. Как можно редактировать геном?
Эволюция методов геномного редактирования насчитывает многие десятилетия и различные техники – от индуцированного мутагенеза с помощью физических (радиация, ультрафиолет) или химических воздействий (колхицин, иприт), которые, однако, приводят к непредсказуемым последствиям, до высокоточных молекулярно-биологических методов изменения ДНК с разрешением вплоть до одного нуклеотида в конкретном месте генома. 6
В основу большинства таких методов легли природные механизмы, заимствованные у разных организмов. Например, популярная система сайт-специфической рекомбинации Cre-loxP из фага P1 получила широкое распространение благодаря простоте 7, позволив получить целые коллекции модифицированных по тысячам разных генов организмов, в особенности, мышей. Вирусы – еще один пример природных генных инженеров, которые способны встраивать свой генетический материал в ДНК клетки-хозяина. Это их свойство взяли на вооружение ученые, вырезав или заменив на необходимые последовательности части вирусных геномов, кодирующие вредоносные белки. Например, многие методы генной терапии основаны на вирусных носителях: препараты Glibera для лечения тяжелой формы панкреатита, Zolgensma – спинальной мышечной атрофии (адено-ассоциированные вирусы), Imlygic – меланомы (вирус простого герпеса), Kymriah – осторой лимфобластной лейкемии (лентивирус) и др. 8
Мобильные генетические элементы, в частности, транспозоны, стали еще одним эффективным инструментом доставки целевых последовательностей в геном благодаря свойству фермента транспозазы вырезать и вставлять участки ДНК. Один из них – транспозон со сказочным названием «спящая красавица», «проспал» в геноме рыб миллионы лет, пока ученые его не «разбудили» и не заставили работать на благо человечества. «Спящая красавица» используется в моделировании и лечении таких заболеваний, как гемофилия, мукополисахараидоз, глиобластома и др. 9
Существенным недостатком вирусных и транспозоновых систем является ненаправленное действие, т.к. вставка ДНК происходит в произвольные места генома и количество вставок сложно контролировать. Следующее поколение методов отличается направленным действием – ферменты для редактирования можно нацелить на конкретное место генома. «Венцом» современного геномного редактирования стал поистине революционный метод CRISPR/Cas, на сегодняшний день не имеющий равных по возможностям и простоте использования. 10 Самая распространенная система CRISPR/Cas9 состоит из двух компонентов: эндонуклеазы Cas9, создающей сайт-специфичный двухцепочечный разрез в ДНК, и гидовой РНК, благодаря которой комплекс находит целевую последовательность. Ответом на разрыв ДНК является работа системы репарации, которая может идти путем негомологичного соединения концов или гомологичной рекомбинации. В первом случае с высокой вероятностью нарушается исходная первичная последовательность целевого участка, во втором – участок с разрывом заменяется любую необходимую исследователю последовательность (Рис. 4).
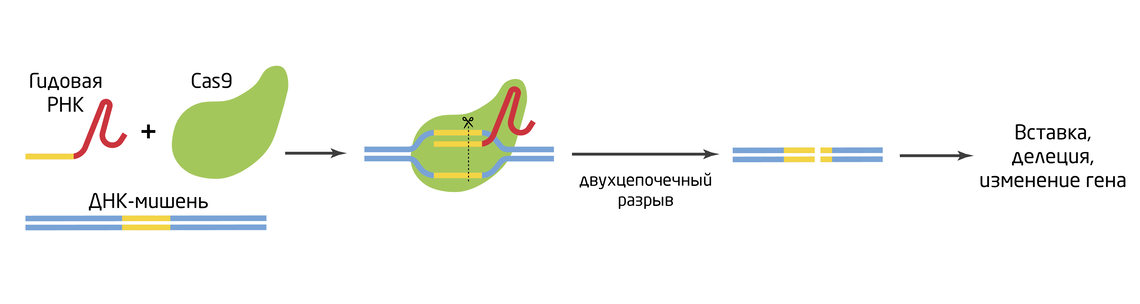
Рис. 4. Система редактирования генома CRISPR/Cas9.
Предшествующие методы были основаны на использовании инженерных нуклеаз (мегануклеаз, ZFN, TALEN), которые находили целевой участок генома с помощью запрограммированных ДНК-связывающих мотивов, однако они требовали много времени и труда, так как для внесения каждой новой мутации нужно было конструировать и экспрессировать новые изоформы этих белков. 11 В случае CRISPA/Cas достаточно лишь заменить короткую последовательность, с которой будет экспрессироваться гРНК.
Еще одно направление геномного редактирования – редактирование оснований – подразумевает направленное действие, но не вызывает разрывов в ДНК. Такой подход позволяет точечно заменять одни нуклеотидные основания на другие, но этого зачастую достаточно, чтобы нокаутировать ген или исправить генетическую мутацию. 12
Точность и специфичность методов геномного редактирования растет и наверняка достаточно скоро достигнет того уровня, когда риски побочных эффектов будут сведены к минимуму или исключены. Однако всё ещё остро стоят этические вопросы, включая использования таких технологий на человеке. Яркий тому пример – новость о первых в мире рожденных в Китае детях с отредактированным геномом на ранних этапах эмбриогенеза. Тем не менее, такие технологии уже сейчас успешно внедряются в практику для редактирования геномов соматических клеток человека в терапии таких генетических заболеваний, как рак, бета-талассемия, серповидноклеточная анемия и многие другие.
Литература
1. Heather J.M., Chain B. The sequence of sequencers: The history of sequencing DNA. Genomics, 2016.
2. Aigrain L. Beginner’s guide to next-generation sequencing. The Biochemist, 2021.
3. Kadri K. Polymerase Chain Reaction (PCR): Principle and Applications. Synthetic Biology, 2019.
4. Creager A. Recipes for recombining DNA: A history of Molecular Cloning: A Laboratory Manual. BJHS Themes, 2020.
5. Fraser C.M. et al. The minimal gene complement of Mycoplasma genitalium. Science, 1995.
6. Вершинина З.Р. и др. Эволюция методов редактирования геномов. Биомика, 2017.
7. Yarmolinsky M., Hoess R. The Legacy of Nat Sternberg: The Genesis of Cre-lox Technology. Annual Review of Virology, 2015.
8. Lapteva L. et al. Clinical Development of Gene Therapies: The First Three Decades and Counting. Molecular Therapy – Methods & Clinical Development, 2020.
9. Aronovich E.L., McIvor R.S., Hackett P.B. The Sleeping Beauty transposon system: a non-viral vector for gene therapy. Human Molecular Genetics, 2011.
10. Barrangou R., Doudna J. Applications of CRISPR technologies in research and beyond. Nature Biotechnology, 2016.
11. Kim H., Kim J.S. A guide to genome engineering with programmable nucleases. Nature Review Genetics, 2014.
12. Anzalone A.V., Randolph P.B., Davis J.R. et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature, 2019.




.jpg)