Медиатека
ДНК-оригами: новый вид искусства или технология будущего?
Оглавление:
•
Возникновение ДНК-оригами
•
Получение ДНК-оригами
•
Применение ДНК-оригами
Уже несколько десятилетий прогресс в области электроники направлен в сторону миниатюризации электронных компонентов. Быстрые и мощные электронные устройства становятся все меньше, делая наши карманы свободнее, а жизнь комфортнее.
Однако микро- и даже наноустройства необходимы не только в электронике. Ряд задач в области материаловедения, физики, химии, биоинженерии, медицины требуют использования наноструктур со строго подобранными физико-химическими свойствами и другими характеристиками, что затрудняет их решение.
Возникновение ДНК-оригами
В 2006 году в журнале Nature вышла статья, в которой Пол Ротемунд (Paul Rothemund) — профессор-исследователь Департамента вычислительных и нейронных систем Калифорнийского технологического университета, США, — показал1, что создавать самые замысловатые нанометровые двумерные структуры (Рис. 1) можно из молекул... ДНК! На самом деле, сама идея возможного использования молекул ДНК в качестве строительного материала для наноструктур была озвучена существенно раньше, еще в 1982 году2, кристаллографом из Нью-Йоркского университета, США, Надрианом Симаном (Nadrian Seeman). А еще за два года до работы Ротемунда молекулярные биологи из Калифорнии продемонстрировали возможность создания из ДНК трехмерной икосаэдрической структуры3. Однако именно работа Ротемунда дала ясное понимание того, насколько широкие перспективы открывает использование ДНК для создания нанообъектов, и послужила мощным толчком для развития ДНК-нанотехнологии. Полученным из ДНК наноструктурам Пол Ротемунд дал название «ДНК-оригами»1, отразив тем самым аналогию между бумажной фигуркой и упакованной в заданную форму нитью ДНК. Такая эффектная демонстрация возможностей метода в сочетании с документированием общих принципов создания ДНК-оригами вызвала повышенный интерес исследователей к новой технологии и привела к дальнейшему развитию направления.
Рис. 1. Изображения из статьи Пола Ротемунда1, демонстрирующее диаграммы сворачивания ДНК в двумерные структуры (два верхних ряда), а также микрофотографии реально полученных наноструктур методом атомно-силовой микроскопии (АСМ) (два нижних ряда). ДНК-оригами получались сворачиванием однонитевой ДНК длиной 7000 пар нуклеотидов (п.н.) в заданную форму. Цвет указывает на индекс п.н. в исходной ДНК нити: 1-ая п.н. — красный, 7000-ая п.н. — фиолетовый.
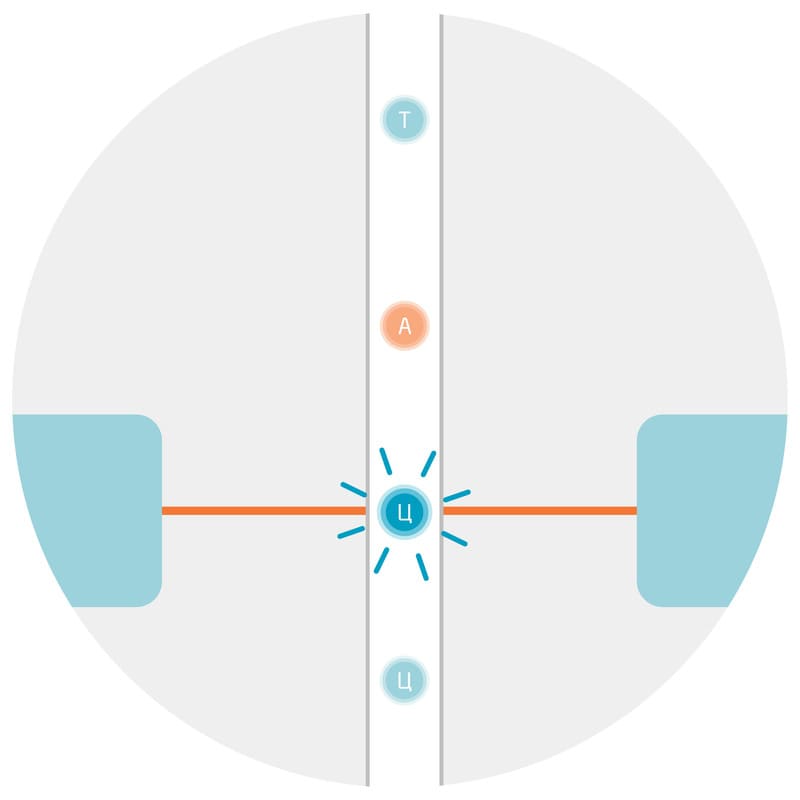
Скептически настроенный читатель вправе возразить: но ведь уже существует ряд нанополимеров с самыми разными характеристиками. В чем же преимущество перед ними ДНК-молекулы, которая выполняет в клетке совсем не структурную функцию? Преимуществ перед другими нанополимерами у ДНК по крайней мере три. Первое — прочность: двухцепочечная ДНК характеризуется высокой стабильностью, так как ее нити связаны друг с другом посредством водородных связей (Рис. 2). Нуклеотиды аденин (А) и тимин (Т) в соседних цепях ДНК комплементарно связываются двумя водородными связями, а гуанин (Г) и цитозин (Ц) — тремя. В результате, хотя энергия одной водородной связи очень мала, прочность фрагмента ДНК из десятков или сотен пар нуклеотидов уже существенно выше, а целая молекула ДНК, в составе которой может быть порядка нескольких миллионов пар нуклеотидов, характеризуется наибольшей стабильностью и особенно жесткой структурой.
Второй важный фактор — это хорошая изученность ДНК в сочетании с легкостью в управлении ее сборкой благодаря линейности и комплементарности этой молекулы. Любой новый полимер требует тщательного исследования характеристик, прежде чем его можно будет использовать для решения практических задач. Изучение свойств ДНК ведется с момента расшифровки ее структуры в 1953 году и признания исключительной важности ее биологической роли. Накопленные знания позволяют с высокой точностью прогнозировать возможности и ограничения при работе с ДНК, выявлять потенциальные проблемы и находить их решения. А это дорогого стоит, в самом прямом смысле: последовательное изучение характеристик нового соединения — процедура, требующая многолетних исследований и постоянного финансирования.
Наконец, еще одно достоинство ДНК — прекрасная совместимость с живыми системами: будучи биологическим полимером, ДНК обладает стабильностью не только в искусственных, но и в естественных средах, богатых биологически активными веществами. Кроме того, в отличие от наноматериалов, которые могут быть токсичными или вызвать аллергическую реакцию, ДНК абсолютно безопасна. Все это означает, что ДНК-наноструктуры способны, не подвергаясь деградации, надежно выполнять свои функции в широких диапазонах физиологических условий.
Рис. 2. Схематическая структура двухцепочечной молекулы ДНК. Каждая цепь представлена четырьмя типами нуклеотидов: А, Т, Г, Ц. Нуклеотиды в противоположных цепях комплементарно связаны водородными связями, согласно правилу Чаргаффа: А=Т, Г≡Ц.4
Получение ДНК-оригами
Разберемся теперь, как же получают ДНК-оригами. Протокол создания ДНК-оригами включает в себя четыре этапа (Рис. 3): проектирование ДНК-оригами, включающее оценку характеристик желаемой наноструктуры и подбор компонентов для химической реакции; собственно синтез ДНК-оригами; очистка и выделение готовых наноструктур из раствора и анализ структуры полученных ДНК-оригами методами микроскопии. Остановимся более подробно на каждом из этапов.
Рис. 3. Стандартный протокол проектирования и сборки ДНК-оригами5. (А) Проектирование ДНК-оригами с помощью специального программного обеспечения. (Б) Добавление ДНК-скрепок в 96-луночные планшеты; смешивание скрепок с каркасной ДНК; сборка ДНК-оригами путем термического отжига. (В) Очистка и выделение правильно собравшихся наноструктур с помощью гель-электрофореза. (Г) Анализ микрофотографий ДНК-оригами.
1. Дизайн ДНК-оригами
Создание ДНК-оригами является длительной и дорогостоящей процедурой. Поэтому прежде, чем начать синтез, важно оценить предполагаемые характеристики желаемой наноструктуры, возможность ее получения, подобрать компоненты и среду для протекания реакции синтеза. Справиться с этими задачами поможет специально разработанное для этого программное обеспечение5. Однако усовершенствование программных продуктов активно продолжается. Свое решение предложила и группа российских исследователей6. На сегодняшний день наиболее надежной и часто используемой программой для дизайна ДНК-оригами структур является caDNAno (Рис. 4).
Рис. 4. ДНК-оригами, спроектированные в программном обеспечении caDNAno: их диаграммы сворачивания, трехмерные модели и микрофотографии реально полученных нанообъектов, АСМ7.
2. Синтез
Как и настоящее оригами, ДНК-оригами получают путем сворачивания однонитевой ДНК в новую структуру. Сворачивание происходит благодаря формированию двухцепочечных фрагментов со специально подобранными на первом этапе короткими ДНК-скрепками, каждая длиной 30-40 п.н. (Рис. 5)
Рис. 5. Проектирование двумерных ДНК-оригами1,5. (А) Общий принцип. (Б) Формирование наноструктуры. За основу берется длинная одноцепочечная «каркасная» ДНК (черная линия). Она зигзагообразно укладывается в заданную форму (ограничена красной линией) за счет формирования двухцепочечных фрагментов со специально подобранными одноцепочечными ДНК-скрепками (цветные линии). Скрепки цепляются своими концами за соседние участки ДНК-нити таким образом, что формируют нужный изгиб и одновременно делают всю структуру прочнее.
Для создания ДНК-оригами за основу берется длинная «каркасная» молекула ДНК. Ее выбор определяется целью синтеза, сложностью и размером будущей наноструктуры. Часто для этой цели используется вирусная ДНК бактериофага m13mp18 длиной 7249 п.н.5 Однако есть и другие стандартные варианты, а при необходимости ДНК может быть изготовлена индивидуально.
Вычислительно подобранные на первом этапе одноцепочечные ДНК-скрепки приобретаются, как правило, в составе 96-луночных планшетов, которые позволяют дозировать скрепки с помощью 8- и 12-канальных дозаторов. Далее подбираются среда и условия протекания реакции. Именно от этого будет зависеть конечный результат сборки. В большинстве протоколов5,8 в качестве буфера используется Трис-ацетат-ЭДТА с рН=8. В состав буфера также входят ионы Mg2+. Их концентрацию подбирают в зависимости от сложности структуры ДНК-оригами: более сложные структуры требуют более высокой концентрации магния.
Далее все компоненты — каркасная ДНК, ДНК-скрепки, буфер — смешиваются и подвергаются отжигу. Отжиг включает две стадии: сначала смесь кратковременно, на 5-10 минут, нагревается до высоких температур (85 или 90°C). При этом разрушаются все двойные связи, и в растворе оказываются только одноцепочечные фрагменты ДНК. Далее следует стадия медленного охлаждения смеси до 25°C, во время которой одноцепочечные ДНК-нити заново самособираются в наиболее энергетически выгодные двухцепочечные структуры. При правильных расчетах на этапе дизайна ДНК-оригами после отжига получается смесь, содержащая в некотором процентном соотношении искомые ДНК-наноструктуры.
3. Очистка и выделение
Задача следующего этапа — отделить желаемые наноструктуры от других компонентов получившейся смеси. Оптимальные методы очистки подбираются с учетом прогнозируемой наноструктуры, а также планируемой цели использования ДНК-оригами. Часто для этой стадии используют электрофорез в агарозном геле5.
4. Структурный анализ
Присоединение всего одной ДНК-скрепки на непредусмотренном для нее участке ДНК может повлечь за собой нарушение посадки других скрепок, дефект всей структуры и, как следствие, нарушение прогнозируемой функции. Чтобы убедиться, что полученные ДНК-оригами не имеют дефектов, после этапа выделения проводится их структурный анализ. Двумерные наноструктуры обычно рассматривают с помощью атомно-силовой микроскопии (АСМ) (Рис. 1 и Рис. 4). Трехмерные ДНК-оригами обычно оценивают, используя трансмиссионую (ТЭМ) или сканирующую (СЭМ) электронную микроскопию (Рис. 6).
Рис. 6. (А) Модели проектируемых двухмерных и трехмерных ДНК-оригами и (Б) ТЭМ-изображения реально полученных наноструктур9.
Применение ДНК-оригами
Оригинальные ДНК-наноструктуры поистине захватывают воображение. Однако помимо эстетической ценности крайне важно, чтобы подобные исследования имели практическое применение. Первые работы по ДНК-оригами изучали, скорее, возможности метода, чем предлагали реальные решения прикладных задач. Текущие же исследования в этом направлении преимущественно практико-ориентированы.
Рис. 7. Хронология ключевых достижений в области ДНК-оригами с примерами возможного внедрения для решения прикладных задач5.
1. Производство наноматериалов
Благодаря возможности проектирования наноструктур практически любой формы ДНК-оригами могут выступать в качестве универсальной инженерной платформы, позволяющей манипулировать нанообъектами: от совсем небольших молекул, например, металлических или полупроводниковых наночастиц, до высокомолекулярных белковых комплексов и нанотрубок5. Так, ДНК-оригами показали свою эффективность при создании подложек и каркасов для конструирования наноматериалов, требующих сверхвысокой точности структуры, вплоть до нескольких ангстрем. Созданные для этих целей ДНК-оригами несут на своей поверхности специальные структуры, работающие как крючки. Они формируют прочный комплекс с нано- или микрочастицами так, что частицы оказываются зафиксированы в строго заданной точке пространства и в определенной ориентации (Рис. 8А, 8Б). Такая технология может обеспечить формирование как простых двумерных, так и крайне сложных трехмерных структур. Немаловажно, что данная технология позволяет получать структуры, которые способны к динамическим перестройкам своей конфигурации под действием заданных стимулов в среде5. Вкупе с физико-химической стабильностью, которая обеспечивает возможность использования подложек и каркасов на основе ДНК-оригами как в растворах, так и на поверхностях материалов, все вышесказанное открывает практически безграничные возможности для создания наноматериалов на основе ДНК-оригами.
2. Катализ
Большинство биохимических реакций, протекающих в живых системах, каталитические. Это означает, что без присутствия в среде особой молекулы — катализатора — реакция между веществами будет протекать очень медленно или не будет протекать вовсе. Оказалось, что наноструктуры, полученные технологией ДНК-оригами, могут выступать в качестве своеобразных катализаторов и облегчать протекание каталитических реакций. Выступая в качестве платформ для пространственной организации молекул, ДНК-оригами способствуют их физическому сближению и протеканию химической реакции. В случае бимолекулярной реакции для этих целей создаются два типа ДНК-оригами с комплементарными друг другу однонитевыми участками. К каждой из них присоединены молекулы либо одного, либо другого вещества из тех, что должны вступить в реакцию. В результате смешения таких комплексов комплементарные участки ДНК-оригами сшиваются, а связываемые ими молекулы оказываются в непосредственной близости друг от друга и вступают в химическую реакцию (Рис. 8В).
Рис. 8. Использование ДНК-оригами для производства наноматериалов (А, Б) и катализа (В)5. (А) Сайт-специфическое связывание наноcтруктур (наночастиц, нанотрубок, и т.д.). (Б) Адсорбция частиц на поверхности ДНК-оригами или в их полостях. (В) Глюкозооксидаза (GOx) и пероксидаза хрена (HRP) оказываются заключены в полость, образованную ДНК-оригами. Пространственная близость между двумя ферментами способствует протеканию между ними химической реакции.
3. Создание молекулярных машин
Формирование между нитями ДНК водородных связей, а также возможность их разрыва легли в основу создания из ДНК-оригами молекулярных машин или, как их иногда называют, — нанороботов. Чтобы заставить молекулу ДНК двигаться, достаточно оставить в ней одноцепочечный фрагмент. В результате образуется динамический домен, который делает возможным изменение конформации наноструктуры. Если сделать такой конформационный переход управляемым, можно говорить о создании настоящей молекулярной машины! За последнее десятилетие появился целый ряд динамических устройств на основе ДНК-оригами, которые отличаются по количеству возможных состояний, типу стимулов, вызывающих переход между ними, скорости и обратимости таких переходов10. Среди разработок есть ДНК-моторы, осуществляющие вращение под действием внешнего стимула; нанороботы, способные доставлять крошечные грузы по заданной траектории; ДНК-коробочки, высвобождающие «грузы» при взаимодействии с определенными лигандами, например, рецепторами клеток-мишеней (Рис. 9), и многое другое. И, хотя такие наномашины способны выполнять лишь весьма ограниченный набор действий и пока еще не добились полноценного признания, потенциал подобных ДНК-наноустройств чрезвычайно высок и в будущем это направление будет активно развиваться.
Рис. 9. Модели динамических наноструктур на основе ДНК-оригами11 и реально спроектированные наноструктуры. (А) ДНК-коробочка, высвобождающая груз при взаимодействии с инициирующим сигналом12. (Б) ДНК-наноробот, способный перемещаться по заданной траектории на платформе из ДНК-оригами13. (В) Наномотор на основе ДНК-оригами14.
Помимо вышеназванных применений, ДНК-оригами имеют широкие перспективы использования в наноэлектронике, создании нанофотодетекторов, изучении биохимических и биофизических процессов, биоимиджинга. Исключительно интересное и активно развивающееся сегодня направление — это создание систем доставки лекарств на основе ДНК-оригами.
На сегодняшний день возможности ДНК-оригами продолжают активно исследовать в рамках ДНК-нанотехнологий. Несмотря на существенный багаж накопленных знаний, ученые продолжают находить все новые и новые применения ДНК-оригами для решения научно-практических задач. То, что вчера казалось фантастикой, сегодня активно разрабатывается, приближая внедрение технологии в производство. Изменит ли технология ДНК-оригами нашу жизнь? Вероятно, об этом мы узнаем уже совсем скоро.
Литература
1. Rothemund P.W. Folding DNA to create nanoscale shapes and patterns. Nature, 2006.
2. Seeman N.C. Nucleic acid junctions and lattices. Journal of Theoretical Biology, 1982.
3. Shih W.M., Quispe J.D., Joyce G.F. A 1.7-kilobase single-stranded DNA that folds into a nanoscale octahedron. Nature, 2004.
4. Wadsworth - Thomson Learning, 2004.
5. Dey S. et al. DNA origami. Nature Reviews Methods Primers, 2021.
6. Reshetnikov R.V. et al. A coarse-grained model for DNA origami. Nucleic Acids Research, 2018.
7. Castro C.E. et al. A primer to scaffolded DNA origami. Nature Methods, 2011.
8. Schmied J.J. et al. DNA origami–based standards for quantitative fluorescence microscopy. Nature protocols, 2014.
9. Liu X. et al. Complex silica composite nanomaterials templated with DNA origami. Nature, 2018.
10. DeLuca M. et al. Dynamic DNA nanotechnology: toward functional nanoscale devices. Nanoscale Horizons, 2020.
11. Ijäs H. et al. Dynamic DNA origami devices: from strand-displacement reactions to external-stimuli responsive systems. International Journal of Molecular Sciences, 2018.
12. Burns J.R. DNA origami inside-out viruses. ACS Synthetic Biology, 2018.
13. Endo M., Sugiyama H. DNA origami nanomachines. Molecules, 2018.
14. Kosuri P. et al. Rotation tracking of genome-processing enzymes using DNA origami rotors. Nature, 2019.




.jpg)