Медиатека
От большого к малому: все о гомогенизации
Оглавление:
• Методы гомогенизации • Какой метод лучше?
Гомогенизация — важный этап подготовки биологических образцов в любом исследовании, включающем анализ, разделение или выделение каких-либо веществ, например, нуклеиновых кислот и белков. Первый этап подобной работы всегда предполагает разрушение и измельчение тканей. Это распространенный и необходимый процесс как в лабораториях, так и во многих отраслях промышленности: химической, фармацевтической, биотехнологической, косметической, пищевой. Именно поэтому понятие гомогенизации достаточно широкое и охватывает множество различных методов. В этой статье мы разберемся, какие существуют методы гомогенизации и для чего они используются.
Методы гомогенизации
Для гомогенизации доступны как немеханические методы, предполагающие наличие каких-либо реагентов для разрушения тканей, так и механические, или физические, использующие только физическое воздействие. 1, 2, 3
1. Химический метод.
Для лизиса клеток химическим методом используют органические растворители, такие как ДМСО, толуол, эфир, бензол, метанол, а также различные поверхностно-активные вещества (ПАВ, или детергенты), ЭДТА, хаотропные соли, и т.д.
Например, ЭДТА используется для разрушения оболочки грамотрицательных бактерий, дестабилизируя липополисахаридный слой и оставляя отверстия в клеточной стенке. Различные ПАВ непосредственно повреждают клеточную стенку или мембрану. Одним из наиболее часто используемых ПАВ является додецилсульфат натрия (SDS), который реорганизует клеточную мембрану, нарушая белок-белковые взаимодействия. Недостатком использования ПАВ для лизиса клеток является то, что многие белки денатурируются в процессе. Кроме того, после лизиса клеток может потребоваться дополнительная стадия очистки. Это ограничивает использование ПАВ в крупномасштабных процессах. Поэтому их обычно используют для однократного лизиса клеток в лаборатории. Хаотропные соли используются для разрушения слабых взаимодействий между молекулами, таких как водородные связи в воде и гидрофобные взаимодействия между белками — они хорошо подходят для выделения нуклеиновых кислот.
Еще одним методом химического разрушения клеток является использование химических растворителей, таких как спирты, диметилсульфоксид, метилэтилкетон или толуол. Они извлекают липидные компоненты клеточной стенки, разрушая ее. Этот метод можно использовать с широким спектром организмов, но проблема также может заключаться в денатурации некоторых белков.
1,
2,
3
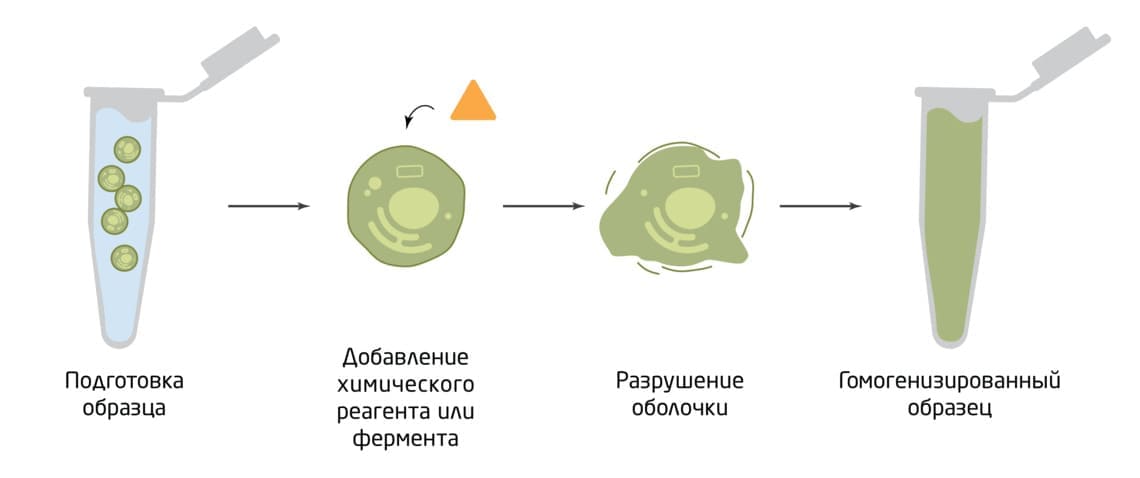
Рис.1. Схема немеханической гомогенизации.
2. Ферментативный метод.
Другая стратегия лизиса клеток заключается в использовании ферментов. Различные типы клеток имеют разные типы клеточных стенок и мембран, поэтому используемый фермент зависит от разрушаемого образца. Например, лизоцим обычно используется для расщепления клеточной стенки грамположительных бактерий, а зимолиаза или литиказа для деградации клеточной стенки дрожжей и грибов. Кроме того, для гомогенизации дрожжей и грибов могут использоваться различные целлюлазы, пектиназы, ксиланазы и хитиназы. 1, 2, 3
3. Механические/физические методы.
Основной принцип механических методов гомогенизации заключается в сильном физическом воздействии на клетки. Без дополнительных химических веществ белки остаются целыми после высвобождения из клетки, поэтому физические методы полезны для выделения белков и ферментных анализов. Основные физические методы — это перетирание в ступке, блендеры, ультразвук, высокое давление и встряхивание с шариками. 1, 2, 3

Рис.2. Физические методы гомогенизации.
Перетирание в ступке
Этот метод гомогенизации довольно прост — образец растирается между ступкой и пестиком до нужной консистенции. Несмотря на кажущуюся примитивность, метод достаточно популярен и применяется повсеместно и по сей день. Он может быть ручными или автоматическим и часто используются при работе с образцами, замороженными в жидком азоте.
Блендеры
Использование специальных высокоскоростных блендеров или даже обычных кухонных блендеров — также распространенный метод измельчения образцов. Название говорит само за себя — ткань интенсивно разрезается на мелкие кусочки, часто в специальном в буфере, в течение времени, достаточного, чтобы разрушить клетки.
Ультразвуковая обработка
Этот метод очень популярен для разрушения растительных и грибковых клеток и подходит для небольшого объема клеточной суспензии. Ультразвуковой зонд генерирует высокочастотные звуковые волны в течение 30-60 секунд. Они в свою очередь вызывают разрушение клеток за счет кавитации — образования пузырьков газа, вызывающих напряжение и разрыв клеток. Поскольку во время этого процесса выделяется значительное количество тепла, во время обработки образец необходимо держать на льду. Ультразвуковая обработка обычно используется в сочетании с химическим методом.
Высокое давление
Гомогенизация высоким давлением — наиболее широко используемый метод для больших объемов материала. Клетки разрушают, продавливая насосом через узкое пространство под высоким давлением. Когда клетки проходят через небольшое отверстие, они сжимаются, а, выходя из него, быстро расширяются, разрушаясь.
Встряхивание с шариками
Это физический метод измельчения с помощью стеклянных, керамических или стальных шариков, который подходит для широкого спектра образцов. Материал быстро встряхивается в закрытой камере, столкновение с шариками приводит к гомогенизации. Шарики могут быть различных размеров, плотностей и форм в зависимости от типа образца и применения. Интересно, что этот метод изначально использовался в лакокрасочной промышленности. Позже его адаптировали для работы в лаборатории.
4
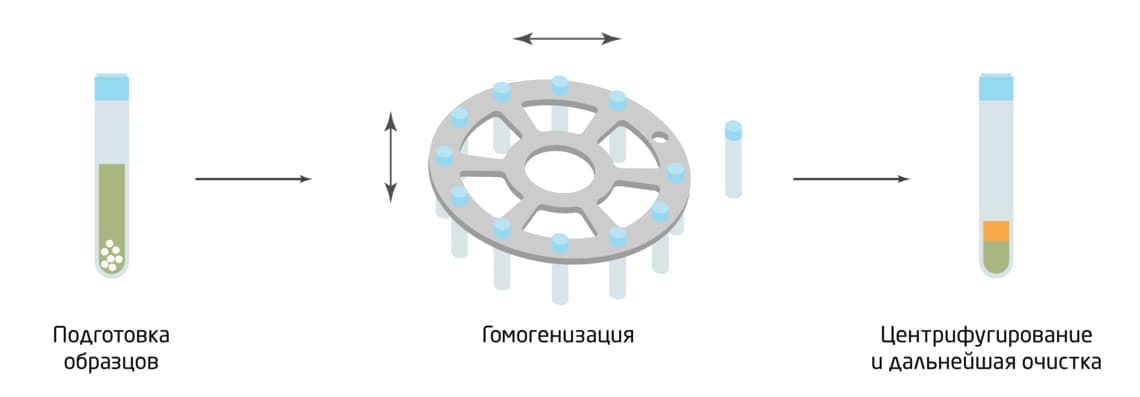
Рис.3. Схема гомогенизации путем встряхивания с шариками.
Другие физические методы разрушения клеток включают замораживание-оттаивание, термолиз, осмотический шок, электрические разряды.
Какой метод лучше?
На практике ученые комбинируют и подбирают методы гомогенизации для наилучшего результата в зависимости от целей исследования. Конечный продукт должен диктовать инструменты и методы, используемые для его производства.
Методы могут варьироваться в зависимости от типа и структуры клеток. Клетки млекопитающих легче всего разрушить, поскольку у них нет клеточной стенки, в отличие от растительных, грибных и бактериальных клеток. Именно поэтому, хотя химические методы предпочтительны для многих типов образцов (например, лизис E. coli с помощью SDS для выделения плазмиды), многие образцы, заключенные в плотные оболочки, не поддаются эффективному химическому разрушению.
Также важно помнить, что хотя ПАВ и хаотропы полезны для выделения нуклеиновых кислот, они могут денатурировать белки. Поэтому их использование может быть нежелательно при очистке белков. То же верно и для литических ферментов, которые в случае очистки белка необходимо впоследствии удалить. Если добавление химических веществ нецелесообразно, альтернативой является механическое и физическое разрушение образцов.
Если требуются кусочки неповрежденной мембраны, то процесс гомогенизации должен эффективно разрушать ткани и клетки, но не допускать полного разрушения клеточных компонентов. Если необходимы активные белки, особенно термолабильные, то следует избегать процессов, которые выделяют тепло или вызывают денатурацию. Если целью является количественное определение аналита, то необходимо высвободить его полностью, при этом избежав деградации.
Важно также проанализировать такие факторы, как вероятность контаминации, максимальный размер образца, скорость, стоимость, воспроизводимость и т.д. Например, перетирание в ступке — это простой и дешевый способ гомогенизации, однако он пригоден только для небольших образцов, и человеческий фактор играет большую роль, приводя к возможным ошибкам. Гомогенизация высоким давлением — это, наоборот, дорогостоящая процедура, требующая специализированного оборудования, однако она подходит для больших объемов материала, имеет высокую воспроизводимость, а также с ее помощью можно добиться очень мелких размеров частиц.
Независимо от используемого метода, основная цель состоит в том, чтобы гомогенизация была эффективной, а извлеченный продукт при необходимости оставался в активной форме.
1,
2
Гомогенизировать биологические образцы можно вручную или с помощью специализированных приборов — гомогенизаторов. Поскольку гомогенизация — это фундаментальная часть многих экспериментов или производств, в настоящее время их существует множество разных видов — от простой ступки с пестиком до больших машин промышленного уровня.
Для работы в лаборатории существуют компактные гомогенизаторы, обладающие достаточной мощностью, чтобы обрабатывать плотные материалы в необходимых количествах. Большой популярностью пользуются гомогенизаторы, работающие по принципу шариковой мельницы — они измельчают образцы, встряхивая их с шариками. Это эффективный способ быстрой обработки нескольких образцов объемом 2 или 5 мл. Для предотвращения перегрева предусмотрена функция охлаждения, что крайне важно для работы с термолабильными веществами. Благодаря небольшому размеру и высокой производительности это оптимальный вариант для любой лаборатории. Кроме того, индивидуальные пробирки предотвращают кросс-контаминацию. Компания Хеликон предлагает широкий выбор оборудования для гомогенизации. В нашем портфолио вы найдёте высокоскоростные гомогенизаторы от компании Allsheng, которые подходят для работы с самыми разными образцами. Bioprep-6 и Bioprep-24 предназначены для одновременного измельчения до 6 и 24 образцов, соответственно, а Bioprep-24R Homogenizer позволяет работать с термолабильными образцами, такими как РНК, ДНК и белки.

Рис.4. Гомогенизаторы типа «шариковая мельница».
Методы гомогенизации — необходимая часть как промышленного производства, так и научных экспериментов меньших масштабов. Все они имеют сильные и слабые стороны — для получения подходящего гомогената важно не только определить, какой конечный продукт необходим, но и проанализировать подходящие для этого методы и оборудование. Хотя гомогенизация — лишь начальный этап эксперимента, выбор инструментов, реагентов и метод их использования могут существенно повлиять на результаты.
Литература
1. Burden D.W. Guide to the disruption of biological samples-2012. Random Primers, 2012.
2. Rahman M. et al. Recovering Microalgal Bioresources: A Review of Cell Disruption Methods and Extraction Technologies. Molecules, 2022.
3. Kakko N., Ivanona N., Rantasalo A. Cell disruption methods. 2016.
4. Geciova J., Bury D., Jelen P. Methods for disruption of microbial cells for potential use in the dairy industry—a review. International Dairy Journal, 2002.




.jpg)